70年前,科学家发现了DNA双螺旋结构,将生物学研究带入分子时代。30年前,我们开启了人类基因组计划,美、英、日、法、德、中6国科学家历经多年努力,共同绘制完成人类基因组序列图,也“绘制”出生命科学史上的一座里程碑。
人类基因组计划引发了生命密码解读的革命,不仅革新了新药与疫苗研发路径,也催生了许多基因组学技术的应用,比如无创产前筛查、血统溯源或亲子鉴定等。相关的技术还对遗传性缺陷、罕见病的鉴别诊断起到很大作用。

2020年10月7日,两位科学家Emmanuelle Charpentier(左)和Jennifer A . Doudna(右)因为“基因组编辑技术”获得诺贝尔化学奖。图|IC photo
2020年,两位科学家因为“基因组编辑技术”获得诺贝尔化学奖。这项被称为“魔剪”的技术应用从植物、啮齿类动物扩展到灵长类动物,且正在被不断优化。
科技的进步从来都是一把双刃剑,基因组学技术亦是如此。在最大化利用这项工具的同时,我们也应充分考虑其安全性及对人类和自然可能存在的影响。
本文为瞭望智库书摘,摘编自《科技之巅(20周年珍藏版):全球突破性技术创新与未来趋势》(人民邮电出版社2023年1月出版),原标题为《生命的本质是无限可能》,原文有删减,不代表瞭望智库观点。
1
多组学出击,
寻找疾病的源头
一间屋子,需要不断地收拾整理,才会保持整洁,否则很快就会变得凌乱。我们身体内的一个个器官、组织、细胞也像一座座小工厂,每天收拾整理,维护生命活动的正常运行,也就是大家熟悉的“新陈代谢”。因此,体内的代谢过程是否正常也意味着体内生命活动是否正常进行。

2022年2月23日,法国里昂,一家实验室的研究人员正在准备人类基因组测序,以更好地识别罕见疾病。
以日常生活为例,一日三餐中人体摄入糖,糖会被肠胃吸收,进入细胞参与代谢,但如果血糖含量过高,就暗示着体内代谢糖的途径可能出现了问题,血液中的糖无法转移。血糖过高的情况下,甚至暗示着参与糖代谢的“人体工厂”出现了问题,例如糖尿病。因此,人们常常将检测血糖含量(而非尿糖含量)作为诊断手段,判断是否患有糖尿病。
按照上述思路,人们提出大胆的想法,是否可以通过检测不同的代谢物,进而预测或诊断不同的疾病?如此,一系列组学分析技术逐渐发展并成熟起来,比如糖组学、代谢组学和比较相互作用组学。这些组学分别是什么呢?为什么如此重要呢?
“组”表示的是某些个体的系统集合,比如糖组学,就是针对所有糖的集合的研究。
有人就会问,糖不就是我们日常生活中的食物、一种营养成分吗?确实,糖可以作为食物为人体提供能量。但糖同时作为生物大分子,也是人体细胞的重要组成部分。人体内的细胞无时无刻不在运转,有些“机器”会老化或故障,这时就需要引入原材料进行修补更新,维持细胞的正常运转。牛奶和鸡蛋中的蛋白质、大米和馒头中的糖类就是人体从外界摄取的原材料。
有趣的是,糖类在人体内发挥作用,和其他生物大分子(例如蛋白质)之间也会互相帮忙、协同作用。其中最重要的相互作用就是糖基化,即蛋白质分子的某个位置会以某种形式连接上某个糖分子。这种糖基化修饰会进一步调整或者彻底改变蛋白质在生命活动中发挥的作用。
以新冠病毒为例,自疫情以来,已有阿尔法、德尔塔和奥密克戎等多种变异类型。这些变异毒株之间的区别在哪里?其中很重要的一点是,人们发现新冠病毒的刺突蛋白在不同毒株上的糖基化修饰方式存在很大的差异。不同的糖基化修饰方式意味着病毒不断调整刺突蛋白这把钥匙,想方设法打开人体细胞的大门。这一系列发现均得益于糖组学分析。
在糖组学发展的同时,代谢组学也不甘落后。代谢与健康密不可分。疾病发生会影响代谢,同时若代谢紊乱也会引起疾病。因此人们希望检测体内各类代谢物作为标志物,更早、更快、更精准地预测疾病。
20世纪70年代,研究人员利用气相色谱技术对患者体液中代谢物进行分析,可被认为是代谢组学的始祖。1983 年,荷兰科学家首次使用核磁共振技术和色质谱联用技术分析尿液中的代谢物。小分子代谢物的分析技术开始建立。
近年来,代谢组学迅速发展,在疾病的发生、进程以及治疗响应等阶段发挥着重要的作用。例如与神经精神疾病领域相关的代谢组学研究在杂志上报道的数量逐年增长,并多发表于高质量的期刊中。
当然,使用代谢组学预测重大疾病,也有很多困难需要克服。首先疾病和标志物之间很难存在一一对应、互不干扰的关系;其次每个人的身体状况不同,体内标志物含量也存在巨大差异,容易对后续的疾病诊断造成误导;同时体内的代谢物千千万万,准确地分离标志物也不是件容易事。
于是人们意识到,单一的代谢组学不是万能的,因此开始尝试将每种组学技术联系起来、多种方法结合使用。
千禧年初,科学家特雷·艾德克尔(Trey Ideker)提出相互作用组学概念,把生物体中的各个反应或通路比喻成“电路系统”。不同生物中存在着不同的电路系统。
这样的生命“电路系统”基础研究,有什么重要意义呢?以疟疾寄生虫为例,其细胞内的“电路系统”和酵母、果蝇、线虫以及人体等生物细胞的存在巨大差异。这个与众不同的“系统”暗示了一个个药物靶点。我们便可以根据寄生虫与人体中“电路系统”的差异,设计一系列药物攻击疟疾寄生虫,但不对人体产生副作用。甚至,可以依据“电路”预测药物在人体试验中的效用。
除了比较物种(寄生虫、果蝇、线虫)之间的相互作用差异之外,人们也开始意识到即便是同一个人身上的不同细胞,比如腹部储存脂肪的脂肪细胞和血液中运输氧气的红细胞之间,也存在功能和机理的巨大差异。于是,单细胞分析(Single Cell Analysis )开始发展。
随着时间的积淀,单细胞分析也向多个领域渗透。清华大学药学院李寅青研究员开发单细胞核基因表达解析技术,追踪和解析了成年人的脊髓神经再生过程,在脊髓神经修复领域有着重要的意义。此外,李寅青的团队还开发了神经单细胞多组学技术,深入研究与遗传性多动症等精神疾病相关的核心神经环路,为筛选药物靶点提供重要依据。
2020 年,麻省理工学院和哈佛大学合作在《细胞》杂志中发表论文,通过单细胞分析生成了人和小鼠的肠神经系统单细胞图谱,推断肠道中的神经元可以和多种其他类型的细胞“交流”。基于该研究,也可以更好地开发出治疗功能障碍的新方法。
2
基因时代,
人类迈向精准医学
由上文可知,千禧年初发展的组学技术在2020年新冠疫情出现时发挥了重要的作用:糖组学分析新冠病毒刺突蛋白糖基化,代谢组学分析轻重症患者差异,比较相关作用组学勾勒新冠病毒蛋白作用图谱……那么,疫情期间我们接触到的核酸检测又属于什么技术?

2021年1月22日,英国维康桑格研究所发布的研究人员于2020年8月提取新冠病毒测试样本并进行测序的照片。
这要提到基因组学的研究了。其内容包括对生物体所有基因进行表征和研究,对不同基因组之间的关系进行分析和比较。
在应用中,DNA测序技术是研究基因组学的重要技术途径。我们接触到的核酸检测,更是DNA测序的重要体现。通过鼻拭或咽拭提取样品,若样本中存在病毒的基因,则意味着“阳性”,反之则为“阴性”。如此便利准确的核酸检测正是一系列测序技术发展的副产物。
早在20世纪末,多个物种的基因组计划就已逐个启动:
1977年,噬菌体(5.4 kbit)测序完成。
1981年,人类细胞器中的线粒体基因组(16.6 kbit)测序完成。
1992年,酿酒酵母Ⅲ号染色体(315 kbit)测序完成。
1995年,嗜血流感菌基因组(1.8 Mbit)测序完成。
1996年,酿酒酵母完整基因组(12.1 Mbit)测序完成。
大众最熟知的莫过于人类基因组计划(又称生命科学的“登月计划”)。2003年,人体基因组DNA中30亿个碱基对(3000 Mbit)的秘密被全部揭晓。自此基因组时代开启,DNA测序技术开始迅速发展。
由于DNA是遗传物质,相比于蛋白、多糖、脂质等生物大分子,其结构和组成比较简单,且十分稳定。因此,相比于其他组学技术,DNA测序技术发展得尤为快速。具有代表性的是个人基因组学(Personal Genomics)、100美元基因组测序($100 Genome)和癌症基因组学(Cancer Genomics)。这3种技术也分别入选了2004年、2009年和2011年的《麻省理工科技评论》“全球十大突破性技术”。
人类基因组计划揭晓30亿个碱基对的遗传信息后,人们开始关注遗传信息带来的个体差异。为什么大家拥有类似的遗传信息,却在发色、肤色、身高等一系列性状中差异巨大呢?佩尔金科学(Perlegen Sciences)公司的首席科学家大卫·考克斯(David Cox)很快提出要寻找个人基因组之间的差异性,将个人基因组测序发展成一种快速有效的疾病检测手段。这种技术方法避免了医生在茫茫30亿个信息里做判断,而是量身定做,针对每个人的基因组测序结果,确定个体是否对某种疾病易感,提前防范。
当然,有的疾病对应着一两个基因突变,此类疾病(如亨廷顿病)比较容易诊断,但也有许多疾病会与多个基因相关,不易判断。此时,个人基因组测序的结果与疾病发病之间的相关程度不够紧密,因此考克斯等人也希望采集海量的个人数据,分析处理得到单核苷酸多态性(SNP)以与疾病之间建立更加紧密的关系。类似“望闻问切”,通过基因的“症状”对个人进行诊断,这也是迈向精准医学的第一步。
【注:亨廷顿病是一种常染色体显性遗传性神经退行性疾病。该病由美国医学家乔治·亨廷顿于1872年发现,因而得名。主要病因是患者第四号染色体上的亨廷顿基因发生变异,产生了变异的蛋白质,该蛋白质在细胞内逐渐聚集在一起,形成大的分子团,在脑中积聚,影响神经细胞的功能。一般患者在中年发病,表现为舞蹈样动作,随着病情进展逐渐丧失说话、行动、思考和吞咽的能力,病情大约会持续发展10年到20年,并最终导致患者死亡。】
为了完成人类基因组计划,全球投入了30亿美元。“私人定制”的个人基因组测序的市场在哪里?随着测序仪器的不断进步,尤其是微流控生物芯片技术(Microfluidics)的进步,极大地降低了基因组测序的成本。2009 年,大部分科学家们保守地认为基因组测序可以降低至1000美元,但同时也提出高目标,在5年内降低基因组测序成本至100美元,即100美元基因组测序。
微流控生物芯片是如何实现降低成本的呢?由于基因组DNA有30亿个“字母”信息要去读取,假设我们把一个人的基因组DNA想象成一根长绳,通常人们会选择把这根长绳切成片段,比如100—1000个字母,测序后,再将片段拼成一根长绳,整个过程的成本很高,也很耗时。微流控生物芯片同样也要把长绳切开,但每个片段可以有100万个字母,这样测序速度提升了,成本也降低了。
在个人基因组测序速度越来越快、成本越来越低时,研究人员提出了新的挑战:单细胞测序。传统的测序一般需要提取数万个细胞中的DNA或者RNA进行测序,常常会对人体细胞的多样性理解产生偏差。而单细胞测序,类似于前文所提的“单细胞分析”技术,是在单个细胞层面进行测序和解析基因组,实现了细胞多样性的表征。

微流控生物芯片
2009年,第一篇单细胞mRNA测序研究问世,标志着单细胞测序技术开始兴起。2018年,高通量单细胞测序技术被《科学》和《自然方法》杂志提名为年度突破技术。单细胞测序技术的细分市场也以年均20%以上的速度逐年增长。
为什么传统测序需要数万个细胞,而单细胞测序只需要单个细胞呢?简单来说,传统测序就像如今核酸检测中的“混检”,数万个细胞会展示出某种性质,如基因突变,至于是哪个或哪种细胞贡献的,无从得知。而单细胞测序就类似于核酸检测中的“单检”,一目了然。同时显而易见,单细胞测序面临着如何降低测序时间、节约测序成本、提高测序准确性的考验。
2016年,10x Genomics公司成功推出全球首款单细胞测序仪Chromium Controller,此后长期占据全球市场。公司凭借着液滴微流控技术,利用含有75万种条形码(Barcode)的油滴包裹的凝胶珠(GEMs),在10分钟内可自动完成8万个细胞的捕获。
总体来说,微流控技术实现了单个细胞的分离,而液滴技术实现了不同细胞中同一基因测序文库的建立。
科学技术的发展没有最好,只有更好。近年来,国内这片沃土也孕育了一批批有志之士,他们的加入为单细胞测序赛道带来了新的生机。
2018年注册成立的新格元(Singleron)公司专注于将单细胞测序技术应用在临床检测、健康管理和药物开发领域。针对不同的样品,新格元实现了测序前样品制备的完整解决方案,便于临床样品的储存、运输。
2021年6月,万乘基因(10K Genomics)公司上线国内首款液滴微流控单细胞测序仪PerseusTM。公司创始人施威扬表示仪器的核心器械都实现了国产化。
2021年4月,中国39家研究所和医院的研究人员与10x Genomics中国区团队携手合作,利用单细胞RNA测序技术处理了来自284个样本中的146万个细胞,对新冠病毒感染后的免疫反应进行深入分析,寻找细胞因子风暴的新元凶,相关工作发表于《细胞》杂志上。大规模单细胞图谱研究的潜力可见一斑。更多的研究和应用都静待单细胞测序技术去大展身手。
3
测序技术还可以带来什么?
全球范围内,高通量、低成本、单细胞、超灵敏的测序技术,发展得日新月异,让人眼花缭乱。
同时,突飞猛进的测序技术也带动了学术界开展更多的研究,例如人们考虑将遗传物质DNA作为数据存储材料。大数据时代的地球每天产生的信息量,远远超过了过去5000年人类文明的信息总和。更有预计称,到2040年,全球需要1×10^6t硅基芯片存储数据。而DNA存储密度大、能耗低、周期长,理论上只需要1kg就能够实现全球信息的存储。
信息存储的流程主要是存储、编码和读取。DNA测序技术对应的是数据的读取,但目前DNA在存储层面还存在合成成本高、速度慢、稳定性差等多个问题。但我们依旧期待DNA成为数据存储材料的未来。投身“人类基因组测序”的科学家们或许也没有想到,有一天基因组测序也会为DNA存储带来腾飞的机会。
此外,2011 年的《麻省理工科技评论》“全球十大突破性技术”之一,癌症基因组学也得益于测序技术的发展。该技术围绕癌症基因图谱测序,进而实现癌症预测或治疗。该技术的领军人物伊莱恩·马尔迪(Elaine Mardis)认为“基因 - 突变 - 治疗”这个方程式过于简单。癌症测序不仅要考虑多种基因突变,还要考虑DNA 测序之外的 RNA 测序。此外,在临床试验中纳入真实数据及推动患者基因数据共享等都要不断地推进实现。
2013年,《科学》杂志用多篇文章专题介绍“癌症基因组学”,提出从测序分析、原则总结、疾病检测和临床影响等方面全面发展。2020年8月,西班牙的研究团队从来自 66 种癌症的28076 个肿瘤样品基因组中鉴定了568个癌症驱动基因,绘制了迄今为止最完整的癌症驱动基因全景图。
癌症基因组学的发展表明,在不久的将来,常规癌症治疗将不再侧重于器官,而会更关注癌症的基因组特征。期待未来,医学专家能够通过读取DNA信息,在治疗过程中为每位患者确定最好的治疗方案。
除了癌症,寿命的延长研究也得益于测序技术的发展。目前,已经有许多基因被证明对多种模式动物的衰老和寿命有广泛影响。这张基因名单还在不断变长。那么对衰老基因的干预是否可以实现寿命延长呢?引用爱因斯坦的一句话:我从来都不思考未来,它来得太快了。
DNA测序技术也带来了广阔的市场前景,全球基因测序行业市场规模不断地扩大。
仅对中国测序市场规模进行分析,2015—2019年,国内基因测序行业市场规模以40%的年均复合增长率增长。未来,以中国为主的亚太地区将成为基因检测的重要市场之一。
从具体诊疗方向来看,肿瘤诊断治疗也是最具潜力市场之一。如此庞大的基因测序市场规模,已经在日常生活的方方面面展现了出来。
孕前检查和产前检查,比如羊水穿刺检测、唐氏筛查、无创产前基因检测等都通过测序技术,结合疾病的遗传模式帮助夫妇孕育健康的宝宝,避免出生缺陷;又如更具科学性的“滴血验亲”——亲子鉴定,便是通过DNA测序实现的。医院中的遗传病筛查、肿瘤靶向治疗等也是DNA测序的应用方向。许多刑事案件中遗留下来的物证,也可以通过提取DNA测序,进而定位犯罪嫌疑人。
甚至,DNA 测序对于每个人的日常生活习惯也存在指导意义。例如由于个体的基因差异,每个人的酒精代谢和咖啡代谢是不同的。通过DNA测序,喝咖啡等许多生活习惯都可量身定做,每个人都可以找到更适合自己的生活方式。
在防疫路上,DNA测序技术帮助人们逐渐从“被动防疫”转化为“实时跟进”。
比如对新冠病毒的追踪。目前为止,新冠病毒已经是地球上被测序最多的生物体,全球阳性样品累积的病毒基因组序列已经实现了超过700万个基因图谱,也让科学家们迅速发现了多种病毒突变体。斯泰伦博斯大学(Stellenbosch University)的科学家图里奥·奥利韦拉(Tulio Oliveira)在2021年11月25日向世界宣布,早在6周之前,奥利韦拉团队就对11月底变异程度最高的突变体奥密克戎隐约有所“感觉”,迅速针对新型病例进行了大量的DNA测序,进而快速确定了奥密克戎突变体。得益于突变体的快速鉴定,围绕奥密克戎的一系列研究迅速开展起来,比如毒株的传染性、毒性,以及对于现有疫苗的敏感度等。同时,一系列政策如旅行禁令、疫苗接种原则等也迅速颁布。
测序能告诉我们以往病毒是如何变异的,目前还无法准确地确定未来病毒会如何演变。但至少,实时追踪已经为全球提供了“早期预警”。
4
神奇的“魔剪”和它隐藏的问题
通过对基因组学分析和基因组测序的了解,我们知道,每个人由于基因组的独特性,对传染疾病的易感程度不同、基因癌变的可能性不同、携带的遗传缺陷基因也存在差异。
例如2013年,安吉丽娜·朱莉基因检测自身为BRCA1/2基因突变携带者,考虑到未来患乳腺癌风险高,进行了双侧乳腺切割手术。“上医治未病,中医治欲病,下医治已病。”人们治疗已经发生或即将发生的疾病,也考虑从源头解决基因缺陷等问题。
因此,和基因相关的技术,如基因组编辑技术、基因疗法也如火如荼地发展了起来。
不过,一直以来人们发展的基因组编辑工具中,有的操作烦琐、有的效率低,一直反应平平。直至2012年,常见回文重复序列簇集CRISPR-Cas9基因编辑技术诞生,并自此开始广泛应用。
2014年,基因组编辑(Genome Editing)技术被《麻省理工科技评论》评为“全球十大突破性技术”之一。珍妮弗·A.杜德纳(Jennifer A.Doudna)和埃马纽埃尔·沙彭蒂耶(Emmanuelle Charpentier)也由于在该技术上的杰出贡献被授予2020年诺贝尔化学奖。
如果将体内带有遗传信息的DNA看作一根长绳,人们希望能够成为完美的裁缝,用一把魔术剪刀,把DNA长绳中有缺陷的位置剪去,或用新的片段替代。CRISPR-Cas9技术就是这样一把魔术剪刀。其最初存在于细菌之中,类似人类的免疫系统,用于抵御外源病毒的进攻。科学家们巧妙地将其改造为基因组编辑的工具。
为何称其为“魔剪”呢?正如我们在基因组测序中所提及的,人类体内的DNA长绳中含有30亿个“字母”,而在编辑过程中,CRISPR技术可以准确地找到其中一个错误,并进行正确修改。CRISPR所做的,相当于我们需要在100万页的文字材料中准确地找到一个错别字,难度可想而知。
至今,世界各地的科学家们依然在不断优化CRISPR技术,实现基因组高活性、高准确度的编辑,也将目标对象从植物、啮齿类动物逐渐扩展到灵长类动物等。
2013年,美国麻省理工学院的科学家张锋和哈佛大学的科学家乔治·丘奇(George Church)成功地将 CRISPR 技术应用于哺乳动物细胞的基因组编辑中。
2013年11月,昆明科灵生物科技有限公司和云南中科灵长类生物医学重点实验室创造出了一对带有精准基因突变的雌性双胞胎恒河猴玲玲和明明。整个过程是先体外受精,接着用 CRISPR 在受精卵中编辑基因,最后将两颗受精卵移植到代孕母猴体内。双胞胎的健康诞生意味着CRISPR技术可以在灵长类动物体内完成基因组编辑。
为何这一突破如此重要呢?很多疾病,尤其是脑部疾病,对机体或行为的影响,还有涉及的神经环路,在人类和啮齿类动物中全然不同。以往在小鼠等啮齿类动物体内进行脑部疾病类药物研发后,后续的人体实验很难成功。
美国麻省理工学院麦戈文脑科学研究所的罗伯特·德西诺内(Robert Desinone)提出,CRISPR 技术可以帮助建立孤独症、精神分裂症、阿尔兹海默症和双向障碍等疾病的灵长类动物模型,这引起科学界相当大的兴趣。
2019年6月,中国科学院深圳先进技术研究院脑认知与脑疾病研究所、美国麻省理工学院、中山大学、华南农业大学等国际一流团队共同合作,利用CRISPR 技术在灵长类动物模型上成功改造了与孤独症高度相关的SHANK3基因。发生基因突变的猕猴表现出与孤独症患者相似的行为特征,比如睡眠紊乱、社会交互减少等。该研究发表于《自然》杂志,为深入理解孤独症的生物学机制和未来开发相应治疗手段提供了研究基础。
2021年,中国科学院昆明动物研究所科学家胡新天和仇子龙课题组合作,使用CRISPR技术直接在成年猕猴黑质区域进行基因编辑,构建了首例成年帕金森病猕猴模型,为帕金森病的干预与治疗提供了平台。该研究发表于《神经科学通报》。
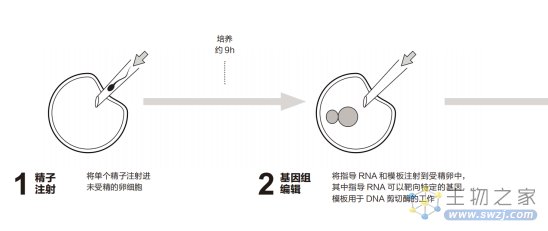
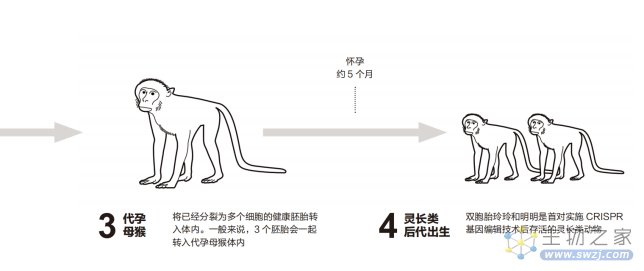
基因编辑过程
除了在灵长类动物中构建疾病模型,近年来,CRISPR也获得了临床方面的胜利。
2020年12月,《新英格兰医学杂志》发表CRISPR治疗(CRISPR Therapeutics) 公司与福泰制药(Vertex Pharmaceutical)合作的CTX001疗法的临床试验结果。与上文所述编辑受精卵基因组有区别的是,CTX001疗法并没有直接编辑患者的基因组,而是先在体外利用CRISPR技术编辑造血干细胞,再将编辑后的造血干细胞输入患者体内。结果显示,患有镰刀型贫血症和β地中海贫血症的患者治疗前平均需要每年输血16.5次,治疗后已不再依赖输血了。
除了体外改造后输入体内的方式,据悉,艾迪塔斯医学(Editas Medicine)公司也正在进行另一项临床试验,将CRISPR系统直接递送至眼睛,治疗先天性黑蒙症。研究者透露6名受试患者中,2名完全失明的患者在3到6个月后能够感应到光线,其中一位在昏暗的灯光中能够识别障碍。
2021年6月,《新英格兰医学杂志》发表了英特里尔治疗(Intellia Therapeutics)公司和再生元公司合作的基因疗法NTLA-2001的临床试验。针对转甲状腺素蛋白淀粉样变性(ATTR)患者,通过纳米颗粒直接将CRISPR系统递送至肝脏进行治疗。数据显示,接受低剂量的3名患者和接受高剂量的3名患者在治疗28天后,体内血浆中转甲状腺素蛋白(TTR)水平平均分别下降52%和87%。
在癌症治疗层面,CRISPR 技术也有重要突破。2020年2月,宾夕法尼亚大学科学家卡尔·琼 (Carl June)在《科学》杂志上发表封面论文,介绍了利用CRISPR编辑T细胞进而治疗癌症的临床试验结果;2020 年 4 月,华西医院卢铀教授在《自然医学》发表论文,介绍了利用CRISPR技术编辑肺癌患者T细胞PD-1基因的临床试验结果。
利用CRISPR编辑基因的临床试验在多种疾病、多个领域的巨大成功,让其入选了《科学》2021年度十大科学突破,也让学术界、工业界、商业界都为之振奋。
CRISPR 技术实现了操作层面编辑基因的可行性,但如今伦理学困境和安全性是人们面临的重要问题。
自该技术问世以来,许多研究也陆续表明CRISPR基因编辑技术隐藏的安全性问题。2018年6月,《自然医学》指出,CRISPR编辑后的细胞中p53基因可能存在缺陷,细胞癌变风险可能提高;2018年8月,《自然》指出,CRISPR基因编辑后的小鼠受精卵中出现大量 DNA 碱基缺失;2021年4月,《自然遗传学》指出,CRISPR基因编辑技术会破坏细胞核结构,最终导致染色体破碎。这一系列的文章也在人们应用技术之际敲响了一记又一记警钟。
其次,针对受精卵的操作,虽然本质上是对一个细胞的处理,但这个细胞后续很有可能会成为一个生命、一个婴儿、一个家庭的希望。因此即使是很微小的错误或者是副作用在未来都可能产生很严重的后果。对于存在简单基因缺陷的受精卵来说,夫妇二人直接选择另一个受精卵或者胚胎或许更好。
当然,很多父母还有让孩子更高挑、更聪明、更健康等愿景,但考虑到基因组编辑中的安全和伦理道德问题,或许我们可以暂时搁置这种大胆的“X战警”想法,陪伴孩子更幸福地成长。
5
60年了,
基因疗法仅发展为2.0版本
除了CRISPR技术,基因疗法也是非常重要的一种从源头解决基因缺陷问题的方式。
正如上文所说,人们目前是将CRISPR“魔剪”工具直接递送到人体指定区域,再对缺陷基因进行编辑,实现疾病治疗。那什么是基因疗法呢?基因疗法是在体外先制备好相关基因的健康版本,再递送到体内,将缺陷的基因替换掉。20世纪60年代,基因疗法的想法问世,随着多年的发展,已经发展为基因治疗2.0(Gene Therapy 2.0)。
为何快60年了,仅发展为2.0版本呢?这其中也有着很曲折和辛酸的故事。
1999年,吉姆·威尔逊(Jim Wilson)开启了针对鸟氨酸氨甲酰基转移酶(OTC)缺乏症的临床试验。这类疾病患者因缺乏OTC基因,无法代谢氨,进而导致毒素在体内积累。但临床试验的一名患者杰西·格尔辛格(Jesse Gelsinger)在接受治疗后,产生了严重的免疫反应。最后,这位18岁的男孩临床试验不幸去世。自此,威尔逊被解职,5年内不得参加任何人体试验。
2000年,在针对重症联合免疫缺陷病(SCID)的临床试验中,一些患者被治愈了,但也有一些患者后续患上了白血病。出于安全考虑,美国食品和药品监督管理局(FDA)迅速撤销了27项相关申请。基因疗法研究一度停滞不前。
“失败乃成功之母”,科学家们屡败屡战,发现核心问题出在递送步骤,于是不断开发更加安全有效的递送工具。沉寂多年,基因疗法2.0版本终于又回到了大众的视野,再次展现出良好的前景。
2012年, 荷兰UniQure 公司开发 Glybera基因制剂,获得欧洲药品管理局批准,并于2014年正式上市。Glybera以腺病毒作为载体,递送正常的脂蛋白脂酶基因,进而治疗家族性脂蛋白脂酶缺乏症(一种极其罕见的成人血液病)。但该制剂平均一次疗法费用高达100万美元,上市4年仅有一位患者接受治疗,2017年4月,UniQure宣布不再申请延期,艰难问世的药物黯然退出市场。

基因编辑时间线
2016 年,葛兰素史克公司开发的 Strimvelis被欧盟批准上市。Strimvelis 是可以表达正常腺苷脱氨酶(ADA)的干细胞,可用于治疗由于ADA 缺陷引起的重症联合免疫缺陷病。2017年,售价64万美元的 Strimvelis 上市一年后也终于迎来了第一位患者。截至2020年,16名患者接受治疗。但2020年10月30日,Orchard Therapeutics公司(2018年从葛兰素史克购买了Strimvelis)表示,该基因疗法被怀疑导致一名患者患上白血病,在调查完成之前,将不会有患者接受该疗法。
基因疗法2.0的故事虽然一波三折,但依然在不断发展。
2015年,一位7岁的小男孩哈桑因交界型大疱性表皮松解症被送进了医院,全身只剩20%的健康皮肤。这种疾病是由于LAMB3基因出现了问题,一般200万人中才有一例突变,患者的皮肤会非常容易破裂、感染等。在意大利和德国的联合行动下,科学家通过基因治疗的方法,在体外修改哈桑的皮肤细胞,并大量培养,再逐步移植到哈桑身上。历经在ICU的整整8个月,哈桑破茧成蝶,重获新生。基因治疗让一个男孩如今快乐地在阳光下奔跑,与小伙伴一起成长。
2017年12月,星火治疗(Spark Therapeutics)公司的 Luxturna被美国食品药品监管局FDA 批准上市,用于治疗遗传性视网膜疾病。一位13岁男孩通过该疗法重见光明。
2017年3月,《新英格兰医学杂志》报道基因疗法药物 LentiGlobin BB305 在临床试验中治愈了地中海贫血症的患者。
2020年,旨在治疗艾滋病的AGT103-T获得美国食品药品监管局FDA批准,开启Ⅰ期临床试验。
2021年,《自然医学》杂志报道通过藻类基因恢复患者失去的视力。
2022年1月,基因治疗药物Zolgensma落地中国,其在中国递交的临床试验申请已获得临床试验默示许可。该药物主要用于治疗2岁以下脊髓性肌萎缩的儿童患者。但Zolgensma药物一针达1300万元,绝对是天价。
从2012年的Glybera到2022年的Zolgensma,为什么基因疗法价格如此昂贵呢?其一源于企业的研发费用,其二源于基因疗法针对的罕见病市场份额相对较小。以Glybera来说,其总研发费用约1亿美元;而当时全欧洲的病患数量总计才200多人。因此市场分摊下来,每个人所承受的价格自然不菲。
目前基因疗法2.0主要针对单基因突变疾病等罕见病,但有些疾病,例如阿尔兹海默病、糖尿病等不仅涉及多个基因,并且在不同病人中对应的基因突变还不完全相同。
总结来看,首先,基因疗法与传统的疾病治疗方法存在显著差异。如果基因疗法面对的是个6个月大的婴儿,但其实这个孩子的一生都体现着治疗的效果。因此对于基因疗法的研发人员来说,需要面对更长时间的挑战,评估疗法的长期影响。
其次,由于目前基因疗法多针对罕见疾病,样本量过少,不利于研发工作和临床试验的开展,未来的市场也相对小众,对研发企业带来了严峻的考验。但正是这重重挑战促使了多种高灵敏度的技术不断被开发,技术和应用互相促进,又相辅相成。
最后,基因疗法目前整体开发流程速度较慢,流程不够自动化,监管指导机制也在不断提高。
面对如此复杂情况的基因疗法还在继续升级:合格的流程、完善的分析、明确的监管指导,减少开发时间和成本。
未来,我们期待着继续撰写基因疗法2.0、3.0……的故事。































