碱基编辑器(Base editor,BE)是一类在单碱基水平实现特定碱基类型高效精准编辑的工具,其极大地促进了基础研究、基因治疗、动植物育种改良等领域的进展。目前广泛使用的DNA碱基编辑器主要是将可编程的DNA结合蛋白(Cas9,Cas12或TALE蛋白变体)与碱基脱氨酶(胞苷脱氨酶或腺苷脱氨酶变体)整合在一起实现的,主要有两种类型:ABE(Adenine base editor,腺嘌呤碱基编辑器)和CBE(Cytosine base editor,胞嘧啶碱基编辑器),分别可以实现A-to-G和C-to-T此类碱基之间的转变【1-2】。在此基础上,研究人员开发出了多种可以实现特定功能的碱基编辑器。比如,在CBE的基础上开发了能实现C-to-G转变的CGBE(C-to-G base editor)【3-6】。最近,杨辉团队在ABE的基础上开发出了能够实现A-to-T和/或A-to-C这类碱基转变的新型DNA碱基编辑器AYBE(adenine transversion base editor)(NBT|杨辉团队开发出新型DNA碱基编辑器首次实现高效的腺嘌呤碱基颠换编辑)【7】。

截止目前,所有的碱基编辑器(包括线粒体碱基编辑器,DdCBE【8-9】)都需要以A或C的脱氨基反应作为起始步骤,才能引发后续的DNA修复过程,进而实现目标碱基的编辑。虽然非编辑链上的G或T在编辑链上的C或A被编辑的同时也会相应发生转变,但受限于PAM及编辑窗口等因素的影响,很多情况下仍需要对G或T进行直接的编辑。现有的脱氨酶不能将基因组DNA中的鸟苷(G)和胸苷(T)催化为其他核苷,因此对鸟苷(G)和胸苷(T)的进行直接编辑在基因编辑领域存在技术空白。
2023年5月16日,辉大(上海)生物科技有限公司杨辉团队(以下简称“辉大基因”)在National Science Review(NSR)上发表了题为 Programmable deaminase-free base editors for G-to-Y conversion by engineered glycosylase 的研究论文。该研究综合利用蛋白质工程、流式细胞术、小鼠胚胎显微注射、深度测序等技术手段,开发出了不依赖任何脱氨酶的新型DNA碱基编辑器——基于工程化的糖基化酶的鸟嘌呤碱基编辑器(glycosylase-based guanine base editor, gGBE)。研究人员对gGBE进行了一系列的工程化改造、蛋白质进化、突变筛选及验证,实现了高效的鸟嘌呤碱基编辑。值得一提的是,本研究提出了基于工程化的糖基化酶的一类碱基编辑器开发的新策略,为进一步丰富碱基编辑工具包、对基础研究领域疾病模型的建立及基因治疗领域等都有着非常重要的意义。
目前还没有一种碱基编辑器可以实现对G或T的直接编辑。由于G脱氨后很少能引起碱基的转变,而T缺少氨基,使得开发能够直接编辑G或T的碱基编辑器仍存在很大的挑战。除碱基脱氨基外,碱基丢失(脱嘌呤/脱嘧啶)也是一种非常普遍的DNA损伤形式。碱基切除修复(base excise repair,BER)可以有效修复因碱基脱氨基或碱基丢失等产生的碱基损伤,而且这一DNA损伤修复途径在DNA碱基编辑器的开发中已广泛应用。研究人员发现N-甲基嘌呤DNA糖基化酶(MPG;也称烷基腺嘌呤DNA糖基化酶,AAG)在体外实验中有较低的切除正常的G的活性【10】,于是设想可以通过工程化改造MPG逐步开发出高效的gGBE,从而实现对G的直接编辑。
研究团队前期通过蛋白质工程优化,获得了高效切除次黄嘌呤碱基(Hx)的MPG变体【7】,而Hx在结构上与G及A非常相似,研究人员首先着手检测不同MPG变体切除G或A的情况。为了便于评估G或A切除事件的发生以及相应的碱基编辑效率,研究人员设计了一套基于内含子剪接可激活的荧光报告系统。在该荧光报告系统中,只有发生了G或A的切除且实现了相应碱基的转变,才能纠正内含子剪接信号使剪接过程正确发生,进而激活绿色荧光蛋白(EGFP)的正常表达,便以结合流式细胞术检测碱基编辑后产生的绿色荧光信号。
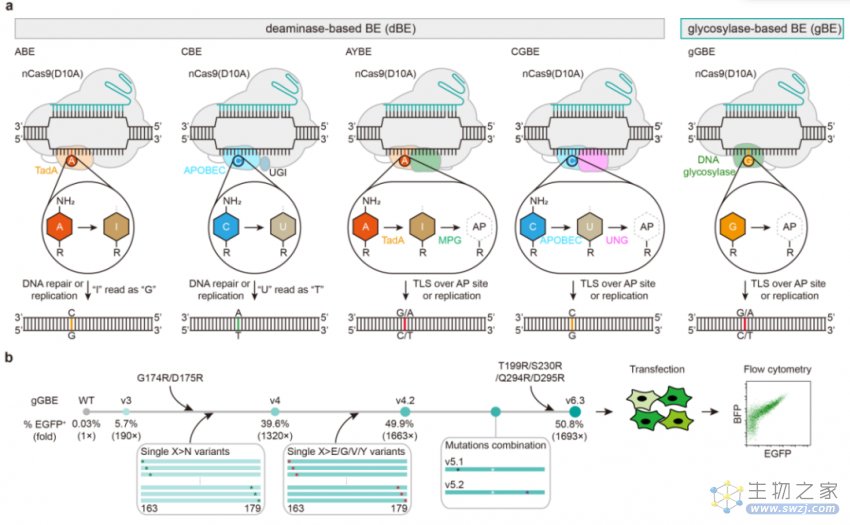
图1:两类碱基编辑器比较及gGBE的蛋白质工程化设计及优化筛选
研究人员将不同版本的MPG变体融合在nCas9的C末端,构建了多个不依赖脱氨酶的基于糖基化酶的碱基编辑器(deaminase-free glycosylase-based base editor, gBE)。利用A-to-T报告系统及G-to-T报告系统评估后,研究人员发现带有MPGv0.2-MPGv3不同变体的gBE都能检测到G-to-T的编辑活性,而没有检测到A-to-T的编辑活性。带有MPGv3的gBE具有最高的活性,而被命名为gGBEv3。为了提升gGBE的编辑活性,研究人员结合蛋白结构分析,对gGBE中的MPG组分进行了理性设计,制定了多种工程化改造策略,构建了一系列突变体库,并利用上述G-to-T报告系统在哺乳动物细胞中开展了多轮的优化筛选,开发出了鸟嘌呤编辑效率较高的gGBEv6.3。结合G-to-T报告系统评估,gGBEv6.3的鸟嘌呤编辑活性(50.8%)是带有野生型MPG版本gGBEv0.1(0.03%)的超过1694倍,获得了非常显著的优化升级(图1)。各个gGBE变体的鸟嘌呤编辑效率在两个內源位点上也得到了验证(鸟嘌呤的总体编辑效率分别从6.4%和7.5%提高到了78.5%和80.3%),而且表现出了较低的indels频率。
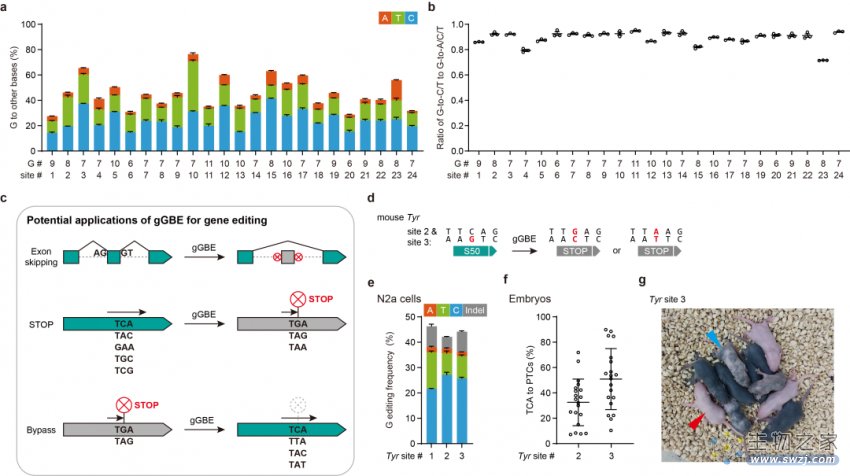
图2:gGBEv6.3在內源位点上的性能评估及相关应用
接着,研究人员在人类基因组内的24个靶点对gGBEv6.3作了综合评估,发现其可实现高达81.2%的鸟嘌呤编辑效率,产物主要是G-to-C和G-to-T的编辑,G-to-Y占比(Y = C or T)可达95%(图2)。通过对sgRNA依赖的及sgRNA非依赖的脱靶分析,研究人员发现gGBEv6.3的DNA脱靶水平较低。本研究也探究了gGBEv6.3在剪接位点编辑、提前终止密码子(premature termination codons, PTCs)的引入等方面的应用潜力。研究人员发现gGBEv6.3可以有效编辑DMD基因第45号外显子的剪接受体位点(总体编辑效率达30.3%)。进一步的研究发现,gGBEv6.3在小鼠胚胎中表现出了高效的体内编辑活性(PTCs引入效率平均达50.9%,最高达89.9%),并且只产生很少的indels。超过57%的F0代小鼠表现出白化或嵌合表型(图2)。
在所有人类致病性SNPs(共60372个)中,约有10%的C-to-G和5%的T-to-G SNPs。尽管CGBE可以纠正C-to-G SNPs【6-10】,但由于PAM的限制和狭窄的编辑窗口,我们通常无法找到有效的sgRNA。与CGBE相比,gGBE可以通过靶向相反的链来增加找到有效sgRNA的机会。对于T到G SNPs,目前没有任何碱基编辑器可以有效地诱导G到T(或反义链中的C到A)转化。因此,gGBE极大地拓宽了基础编辑器的目标范围。
总的来说,该研究创造性地设计了一种不依赖任何脱氨酶的新型DNA碱基编辑器,通过蛋白质工程优化开发出了基于糖基化酶的鸟嘌呤碱基编辑器。这一工作不仅填补了目前碱基编辑器不能直接编辑G的空白,而且提出了基于糖基化酶的一类新型碱基编辑器开发的策略,为丰富基础研究及基因治疗领域研究的碱基编辑工具包有着非常重要的意义。
辉大基因创新研究院童华威博士、刘纳纳博士、魏迎辉博士、周英思博士、李芸和吴丹妮为该论文的共同第一作者。辉大基因创始人&首席科学顾问杨辉博士、辉大基因创新研究院童华威博士为该论文的通讯作者。
原文链接:https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwad143/7165770
参考文献
1. Gaudelli, N.M. et al. Programmable base editing of A*T to G*C in genomic DNA without DNA cleavage. Nature 551, 464-471 (2017).
2. Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. & Liu, D.R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420-424 (2016).
3. Kurt, I.C. et al. CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells. Nat Biotechnol 39, 41-46 (2021).
4. Zhao, D. et al. Glycosylase base editors enable C-to-A and C-to-G base changes. Nat Biotechnol 39, 35-40 (2021).
5. Koblan, L.W. et al. Efficient C*G-to-G*C base editors developed using CRISPRi screens, target-library analysis, and machine learning. Nat Biotechnol 39, 1414-1425 (2021).
6. Yuan, T. et al. Optimization of C-to-G base editors with sequence context preference predictable by machine learning methods. Nat Commun 12, 4902 (2021).
7. Tong H, Wang X, Liu Y, et al.; Programmable A-to-Y base editing by fusing an adenine base editor with an N-methylpurine DNA glycosylase. Nat Biotechnol 2023. doi: 10.1038/s41587-022-01595-6.
8. Mok BY, de Moraes MH, Zeng J, et al.; A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature 2020;583(7817):631-637. doi: 10.1038/s41586-020-2477-4.
9. Lei Z, Meng H, Liu L, et al.; Mitochondrial base editor induces substantial nuclear off-target mutations. Nature 2022;606(7915):804-811. doi: 10.1038/s41586-022-04836-5.
10. Berdal KG, Johansen RF, Seeberg E; Release of normal bases from intact DNA by a native DNA repair enzyme. EMBO J 1998;17(2):363-7. doi: 10.1093/emboj/17.2.363.































