炎症是机体应对组织损害,病原菌入侵的系列生理反应。过犹不及,而巨噬细胞和其他免疫细胞会引起过度炎症反应,也对生物体造成伤害。控制过度的炎症反应有效药物非常稀少,是未被满足的临床需求之一。
CD44+是细胞膜表面的糖蛋白,是透明质酸主要的受体。2020年,来自法国居里研究院的Raphaël Rodriguez研究组发现了CD44-透明质酸介导的铁离子内吞通路。这一非经典铁离子内吞通路改变了癌症细胞的表观遗传景观。具体来讲,内吞铁离子活化了受其依赖工作的去甲基化酶,解除了受甲基化抑制的基因转录抑制,特别是EMT基因的转录【1】。有研究提示透明质酸会诱导肺泡巨噬细胞表达促炎细胞因子。巨噬细胞活化涉及染色质水平的重塑和调节,这促使了Rodriguez研究组进一步探究CD44-透明质酸是否参与了炎症反应中巨噬细胞的调节,及其可能的具体机制。
近日,Nature在线发表了法国居里研究院Raphaël Rodriguez研究组另一项工作,题为:A druggable copper-signalling pathway that drives inflammation。研究揭示了巨噬细胞激活过程中CD44-透明质酸介导的铜离子内吞,造成了线粒体铜离子浓度升高,进而影响细胞代谢和表观遗传重编程的路径。

Raphaël Rodriguez研究组专精于通过化学生物学等多种手段探索金属离子对机体的调控。CD44在炎症巨噬细胞中表达上调,在发现了CD44-透明质酸介导铁离子内吞后,他们进一步在炎症巨噬细胞激活过程中探索金属离子可能的作用和具体机制。研究从供体单核细胞分化获得巨噬细胞,发现在激活过程中,不仅CD44表达升高,铁、铜、锰离子和钙离子在细胞内出现累积。而相应金属离子转运载体并未表达上调。炎症巨噬细胞同时还升高了透明质酸合成酶表达并降低铜离子外排通道的表达,提示透明质酸-CD44-铜离子路径可能是巨噬细胞激活的关键。通过溶酶体铜离子指示剂,他们观察到调节CD44、透明质酸水平,溶酶体内铜离子的浓度出现了很大改变,巨噬细胞转变也受到阻滞。NMR显示透明质酸体外结合铜离子。综合上述证据,表明在炎症巨噬细胞激活过程中,CD44-透明质酸介导铜离子内吞,并关系炎症巨噬细胞的激活。
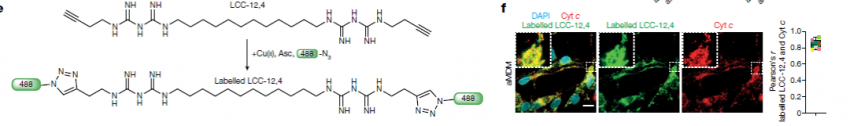
Rodriguez早在2018年发表了关于二甲双胍和铜离子形成生物复合体的研究【2】。在这次的研究中,他们设计合成了类似的双胍二体 LCC-12。LCC-12是一个脂类铜离子“夹片”,在体外显示了和二价铜离子的强结合。在细胞原位进行LCC-12偶联荧光探针显示线粒体定位,定位和线粒体膜电势相关。有趣的是荧光探针点击偶联反应本身需要二价铜离子,因此作者在细胞内偶联反应故意不添加铜离子,LCC-12分子也可标记同时显示也是线粒体定位,进一步提示线粒体积累了活性二价铜离子。值得关注的是,LCC-12分子并不是一个铜离子载体(cuprphore),不改变细胞本来的铜离子浓度,LCC-12将二价铜离子“锁”住,使其不能发挥正常的催化反应,因此成为了有效的铜离子浓度负调控工具分子,研究生理条件下铜离子浓度改变对细胞的影响。
有了趁手的工具,Rodriguez团队检测了铜离子对其他免疫细胞的激活调节作用。CD44在T细胞,树突状细胞和其他种类巨噬细胞激活过程中均表达上调,LCC-12对上述细胞的改变造成了干扰,并且同时影响了多个细胞表面标签分子的表达。中性粒细胞没有CD44表达上调,因而也不受到LCC-12的影响。
铜离子是细胞多种生化反应重要的催化分子,NADH氧化生成NAD+需要二价铜和过氧化氢的帮助。在炎症巨噬细胞激活时,多个依赖于NAD(H)的关键代谢物水平出现改变;NAD+水平较之激活前下降,说明NAD+消耗加剧,线粒体二价铜对NAD+补充有关键作用。LCC-12分子加入可阻扰巨噬细胞激活过程中代谢改变,特别也影响了alpha-KG和acetyl-CoA水平,从而改变了去甲基化酶和乙酰转移酶的工作,带来了表观遗传水平的改变。
作者还建立了巨噬细胞激活中的转录图谱变化,并和SARS-CoV-2感染人群来源的肺部炎症巨噬细胞转录谱进行了比较。同时他们还将人源巨噬细胞暴露于不同感染源,监测了转录改变。研究表明巨噬细胞在应对不同的感染源时,进入炎症状态进行了相似表观遗传的变化。最后在急性感染以及SARS-CoV-2感染动物模型中,腹腔注射LCC-12分子能有效减轻炎症,控制过度炎症的不良反应。
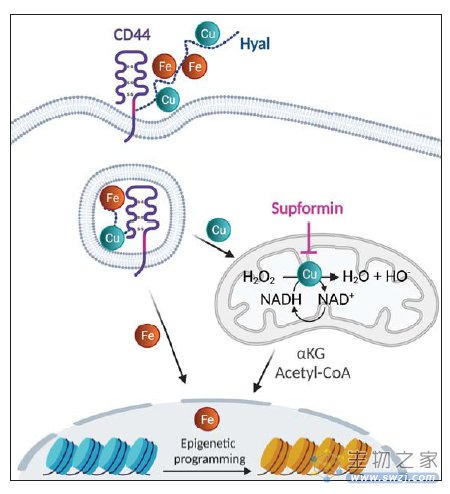
综上,Rodriguez研究组系统工作揭示了金属离子在机体炎症反应中的重要调控作用,他们还设计LCC-12-Supformin分子,改变了线粒体的活性二价铜水平,成为控制过度炎症反应的重要工具。
原文链接:https://doi.org/10.1038/s41586-023-06017-4
参考文献
1. Müller, S. et al. CD44 regulates epigenetic plasticity by mediating iron endocytosis. Nat. Chem. 12, 929–938 (2020).
2. Müller, S. et al. Metformin reveals a mitochondrial copper addiction of mesenchymal cancer cells. PLOS ONE, 13(11): e0206764 (2018)































