在癌症和感染中,病变细胞通过“由内到外”的信号传导过程呈现给人类Vγ9Vδ2 T细胞,在这个过程中,结构多样的磷酸抗原(pAg)分子被细胞内亲丁酸蛋白BTN3A1的结构域感知。
2023年9月6日,清华大学张永辉及湖北大学郭瑞庭共同通讯在Nature 在线发表题为”Phosphoantigens glue butyrophilin 3A1 and 2A1 to activate Vγ9Vδ2 T cells“的研究论文,该研究展示了在人类和羊驼中,多个pAgs如何作为“分子胶”发挥作用,促进BTN3A1细胞内结构域与结构相似的亲丁酸蛋白BTN2A1之间的异聚结合。X射线晶体学研究表明,BTN3A1与pAg的结合形成了与BTN2A1直接结合的复合界面,各种pAg分子分别位于界面的中心,并以不同的亲和力粘合亲丁酸蛋白。
结构见解指导了诱变实验,导致细胞内BTN3A1-BTN2A1关联的破坏,消除了pAg介导的Vγ9Vδ2 T细胞活化。利用基于结构的分子动力学模拟、19F-NMR研究、嵌合受体工程和细胞间结合力的直接测量进行分析,揭示了pAg介导的BTN2A1关联如何以热力学有利的方式驱动BTN3A1细胞内波动,从而使BTN3A1从BTN2A1外畴推出,启动T细胞受体介导的γδ T细胞活化。实际上,该研究利用分子胶模型设计免疫疗法,展示了开发人类γδ T细胞功能的小分子激活剂和抑制剂的化学原理。

T细胞分为αβ T细胞和γδ T细胞两大家族,由它们的T细胞受体(TCRs)来定义。在过去的40年里,关于αβ T细胞如何识别它们的抗原的知识已经大大扩展。αβ T细胞识别抗原的共同特征是所有抗原结合在主要组织相容性复合体(MHC)(或MHC样)抗原呈递分子的细胞外区域形成的凹槽中,从而能够与αβ TCR直接相互作用。与αβ T细胞相比,γδ T细胞识别抗原的分子基础尚不清楚。Vγ9Vδ2 T细胞-人类循环γδ T细胞的主要亚型-以MHC不依赖的方式对多种癌症和传染病作出反应,它们被称为pAgs的小的非肽二磷酸代谢物特异性激活。
20世纪90年代的研究表明,类异戊二烯的普遍前体,二磷酸异戊烯基(IPP)和二磷酸二甲基烯基(DMAPP)可以弱激活Vγ9Vδ2 T细胞,这些小分子已知在肿瘤发生过程中在细胞内积聚。后来的研究发现了DMAPP的羟基类似物,(E)-1-羟基-2-甲基-但2-烯基4-二磷酸(HMBPP),作为一种很强的生物来源的pAg,在皮摩尔范围内具有Vγ9Vδ2 T细胞活化的最大有效浓度(EC50)的一半。HMBPP被认为是一种外源性pAg,由一系列病原体通过甲基赤藓糖醇4-磷酸途径产生。
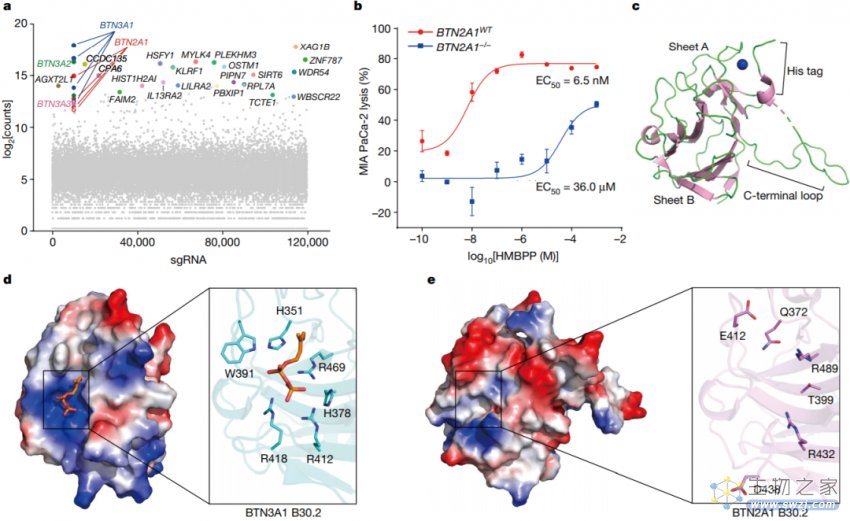
BTN2A1对pAg传感至关重要,但不直接与pAg结合(图源自Nature)
靶细胞中pAgs的感知需要一种具有胞内和胞外结构域的表面蛋白BTN3A。虽然pAgs结合位点最初与细胞外结构域相连,但这一观点后来被修正,现在有晶体学证据表明HMBPP与BTN3A1的细胞内B30.2结构域结合。这种细胞内结合触发细胞外构象变化,使靶细胞能够被γδ T细胞识别,这一过程被称为内向外信号传导。单独的BTN3A1单体不太可能触发pAgs诱导的细胞外构象变化。也有人提出,BTN3A1二聚体或具有一个(或多个)辅助蛋白的复合物负责将细胞内pAgs识别事件翻译为细胞外变化以激活γδ T细胞。这些发现影响了鉴定参与传递pAg传感信号的辅助蛋白的工作。
在此期间,BTN2A1被证明是一个直接的Vγ9 TCR配体,这与早期报道BTNL3-BTNL8异源二聚体响应Vγ4 TCR以及BTNL3 IgV结构域直接与Vγ4TCR相互作用的报道相一致。后来,多个pAg可以促进BTN3A1和BTN2A1细胞内结构域之间的联系,另一项研究描述了所谓的HMBPP受体复合物,包括结合的pAg配体和BTN2A1和BTN3A1细胞内结构域。因此,BTN3A1和BTN2A1显然都发挥着pAg传感器和TCR配体的双重功能,尽管细胞内外事件的结构基础尚未阐明,特异性pAg在γδ T细胞活化过程中的离散影响仍不清楚。
该研究展示了在人类和羊驼中,多个pAgs如何作为“分子胶”发挥作用,促进BTN3A1细胞内结构域与结构相似的亲丁酸蛋白BTN2A1之间的异聚结合。X射线晶体学研究表明,BTN3A1与pAg的结合形成了与BTN2A1直接结合的复合界面,各种pAg分子分别位于界面的中心,并以不同的亲和力粘合亲丁酸蛋白。
结构见解指导了诱变实验,导致细胞内BTN3A1-BTN2A1关联的破坏,消除了pAg介导的Vγ9Vδ2 T细胞活化。利用基于结构的分子动力学模拟、19F-NMR研究、嵌合受体工程和细胞间结合力的直接测量进行分析,揭示了pAg介导的BTN2A1关联如何以热力学有利的方式驱动BTN3A1细胞内波动,从而使BTN3A1从BTN2A1外畴推出,启动T细胞受体介导的γδ T细胞活化。实际上,该研究利用分子胶模型设计免疫疗法,展示了开发人类γδ T细胞功能的小分子激活剂和抑制剂的化学原理。
清华大学药学院袁琳洁博士为论文第一作者,马先强博士及湖北大学杨云云副教授为共同第一作者。张永辉教授为论文通讯作者,湖北大学郭瑞庭教授为共同通讯作者。研究得到了北京自然科学基金委、国家自然科学基金委、科技部、湖北洪山实验室等项目的支持。































