对T细胞进行基因改造使其表达特定的T细胞受体(T cell receptors, TCRs)或嵌合抗原受体(Chimeric antigen receptors, CARs)已经成为治疗恶性肿瘤的有效方法。然而,T细胞功能可能会由于长期刺激而出现耗竭,具体表现为表观遗传改变、细胞增殖能力下降、产生细胞因子水平降低、并且细胞会表达PD-1、LAG-3等抑制性受体【1】。因此,通过基因工程技术提高T细胞在长期刺激和激活下的功能和适应性是提高临床反应的一个有前途的策略。
近日,来自美国加州大学旧金山分校的Alexander Marson研究团队在Cell杂志在线发表了题目为Modular pooled discovery of synthetic knockin sequences to program durable cell therapies的文章,在这项研究中,研究人员开发了ModPoKI(Modular pooled knockin)筛选平台,向T细胞的TRAC(TCR alpha constant)位点敲入特定的文库序列(转录因子或蛋白、表面受体),进而筛选出在体外和体内对长期刺激的适应性及抗肿瘤免疫功能有所提高的基因组工程化的T细胞。他们发现同时敲入BATF和TRAP4能够显著提升T细胞面对长期刺激的适应性、对肿瘤细胞的杀伤能力,并利用CHIP-seq和ATAC-seq揭示了TRAP4显著影响T细胞功能的机制。总之,该研究建立了一套可用于高通量筛选和鉴定提高T细胞功能的敲入序列的方法,为构建基因组工程化细胞免疫疗法提供了高效技术手段。

为了实现大规模的基因片段敲入筛选,作者开发了ModPoKI平台,将功能元件(转录因子和表面受体)片段,与特异性模块(TCR或CAR)片段相连,通过CRISPR-Cas9系统以非病毒感染的电转方式将上述片段整合到人类T细胞的TRAC基因位点中。功能元件由两条特异性条形码(Barcode)序列所标记,后续可以根据条形码特异的扩增子来反映敲入目的片段T细胞的数量。相比于作者之前开发的PoKI(Pooled Knockin),ModPoKI筛选范围更广,具有更高的敏感性、特异性和准确性【2】。基于转录因子和表面受体的功能,作者挑选了100个转录因子和129个表面受体用于筛选。大部分转录因子均与T细胞增至分化、杀伤抗肿瘤能力相关。表面受体主要包括合成嵌合受体(“开关受体”,将抑制性受体的胞外段与激活性受体的胞内段相连,达到抑制性信号-激活性信号转化的目的)。
作者将T细胞面对单次刺激、长期刺激和强直激活(Tonic signaling)情况下能力的改变作为敲入片段的筛选标准,发现敲入特定序列片段能够提升T细胞面对不同刺激情况的适应性。将上述转录因子或表面受体引入到NY-ESO-1 TCR-T细胞后,作者首先利用多种方式:仅CD3刺激、CD3/CD28磁珠刺激、过度CD3/CD28刺激或与NY-ESO-1+靶细胞对T细胞进行单次刺激。通过条形码扩增子测序比较不同敲入片段的表达丰度,来判断敲入后T细胞的数量(即适应性)。结果表示,敲入碱性亮氨酸拉链(Basic leucine zipper)转录因子(BATF和BATF3)、螺旋-环-螺旋(Helix-loop-helix)转录因子(ID2和ID3)后,T细胞适应性有了显著提升。另一方面,嵌入多种融合表面受体:CTLA-4/CD28,FAS/OX40等也能够显著提升T细胞适应性。这些结果初步表明,通过人为敲入表达转录因子或表面融合受体,能够有效提升T细胞在单次刺激下的适应性。
为模拟长期刺激,作者将T细胞连续五次暴露于新鲜癌细胞,他们发现敲入转录因子(BATF和BATF3、TFAP4)和表面受体(白介素2型受体IL2RA和氨基酸转运体)的T细胞在重复刺激后数量较多,适应性显著高于对照T细胞。作者对这部分细胞进行了单细胞测序和半监督转录组聚类,其中有一簇CD8 T细胞高度表达增殖相关的基因,并且富集表达了多种在重复刺激下能够提升T细胞适应性的转录因子如BATF3和TFAP4。非常有趣的是,TFAP4的敲入只影响T细胞对重复刺激的适应度。此外,作者还发现敲入TRAP4能够显著缓解T细胞的耗竭,升高T细胞内IL-2RA及IL2/STAT5信号通路水平,并且增加IFN-γ等效应细胞因子的产生。这部分结果表明,在T细胞中人为表达转录因子(如TFAP4)能够显著提升T细胞面对长期和强直刺激的适应度和免疫能力。
尽管CD19-BBz CAR-T细胞(抗CD19的CAR-T)已经在临床上获得较好的治疗效果[3],但作者同样发现敲入表达BATF、BATF3、TFAP4或CTLA-4/CD28融合受体能够增加CD19-BBz CAR-T细胞面对重复刺激的适应性,进一步强调了筛选T细胞基因工程化新方案的重要性。接着,作者发现同时敲入两个转录因子组合能够进一步提升T细胞功能。向“耗竭样”的HA-GD2-28z CAR T细胞中同时敲入表达TFAP4和BATF(或BATF3),T细胞存活时间长于敲入单个转录因子的存活时间,并具有更强的杀伤能力,也更接近记忆T细胞的状态。
对敲入TFAP4和tNGFR(对照序列)的HA-GD2-28z CAR-T cells进行ChIP-seq和ATAC-seq,作者鉴定出了2232个TFAP4敲入调节的基因,他们发现TFAP4具有染色质重塑能力,与受调节基因的启动子和基因近段增强子结合,促进了T细胞适应功能基因(IL2RA、IL12H和MYC等)的表达,抑制了T细胞功能障碍标记物(CD244,CXCR6和TIM-3等)的表达,表达升高的基因富集于翻译起始和细胞分裂生物合成相关通路。通过分析同时敲入BATF与TFAP4的T细胞染色质开放情况,他们发现BATF和TFAP4之间存在协同促进作用,两者能够合作调控多个与T细胞激活相关基因的表达;BATF还可以打开TFAP4结合位点周围的染色质区域,促进TFAP4与基因组的结合。总的来说,TFAP4是一种具有染色质重塑活性的转录因子,通过增强T细胞的增殖能力并抑制耗竭标记来平衡/优化T细胞行为,BATF通过两种机制辅助TFAP4更好地与基因组结合,从而增强其对T细胞功能的改善。
综上,这篇文章提供了一个向特定基因位点敲入片段并进行大规模文库筛选的平台—ModPoKI,并借此为我们揭示了BATF和TFAP4基因片段敲入能够显著改善T细胞功能,以及背后的分子机制,为开发肿瘤免疫疗法的新型CAR-T提供了潜在的治疗靶点。
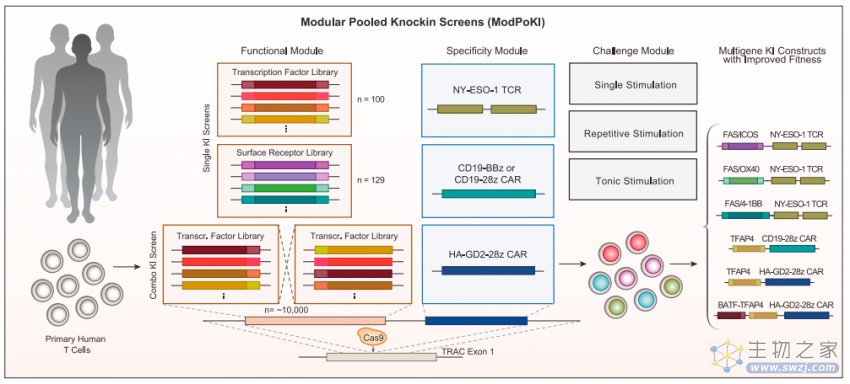
ModPoKI平台示意图
原文链接:https://doi.org/10.1016/j.cell.2023.08.013
参考文献
1. Fesnak, A.D., C.H. June, and B.L. Levine, Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer, 2016. 16(9): p. 566-81.
2. Roth, T.L., et al., Pooled Knockin Targeting for Genome Engineering of Cellular Immunotherapies. Cell, 2020. 181(3): p. 728-744.e21.
3. Ying, Z., et al., A safe and potent anti-CD19 CAR T cell therapy. 2019. 25(6): p. 947-953.































