在不同的动物中,尾巴的形态和功能都差别很大,对于灵长类动物来说,尾巴对于适应各种环境十分重要,也是对于爬行的生活方式不可或缺的一部分。在进化过程中,人类失去尾巴是最显著的解剖形态变化之一,并可能直接或间接促进了人类直立行走。然而,导致人类进化过程中失去尾巴这一现象的遗传机制仍不清楚。
近日,来自美国纽约大学的Itai Yanai、Jef D. Boeke和Bo Xia(第一作者兼共同通讯)研究团队在Nature上发表题为On the genetic basis of tail-loss evolution in humans and apes的文章,发现在人类祖先基因组中Alu元件插入到TBXT基因的内含子中可能是导致进化过程中尾巴缺失的原因,在转录时该Alu元件可能与附近的另一个反向的Alu元件配对,导致可变剪接事件,并在小鼠上模拟和再现了这一现象。

为了找到与人类失去尾巴相关的遗传变体,研究人员首先筛选了31个突变与尾巴缺失相关的人类基因及其灵长目同源基因,由于无法找到编码区的单核苷酸变体(SNV),他们进一步拓展基因范围并尝试寻找基因上下游区域,但仍没能找到可能直接导致尾巴消失的SNV,然后他们检测了这些与尾巴发育相关的人科特异的非编码变体,发现在TBXT基因的第6个内含子中有一个Alu元件,该元件是人科特有的,属于AluY亚家族,是人科和旧大陆猴共有的,相对年轻,并且推测的Alu插入时间与早期类人猿失去尾巴的进化阶段相符。TBXT编码一个高度保守的转录因子,对于中胚层和内胚层形成至关重要,在小鼠、猫、狗、斑马鱼中,其编码区的杂合突变会导致尾巴变短或缺失,而纯合突变通常是致死的。于是他们推测Alu元件的插入可能导致了该基因可变剪接时间的改变,该元件并不是插入在剪接位点附近,而是离最近的外显子都有>500 bp的距离。他们进一步发现在所有猴类和猿类中,TBXT基因的内含子中还有一个反向的AluSx1元件,他们猜测这两个元件形成的包围外显子的反向重复序列在转录过程中会形成茎环结构,导致跳过中间的这个外显子,形成人科动物特有的亚型TBXT∆exon6,并验证了该亚型在人类中存在,而在小鼠中不存在。
接下来他们利用CRISPR-Cas9在人类胚胎干细胞系中分别敲除AluY元件和AluSx1元件,发现敲除AluY几乎完全抑制了TBXT∆exon6的产生,敲除AluSx1也足以抑制TBXT∆exon6的产生。值得注意的是,野生型人类ES细胞也会表达一个之前未注意到的小的转录本,该转录本缺失外显子6和7,导致移码和提前终止,而敲除AluY导致这一TBXT∆exon6-7的水平轻微增加,敲除AluSx1后TBXT∆exon6-7转录本消失,这可能是AluSx1和内含子7中的一个反向AluSq2元件互作的结果,因此内含子中的转座元件可以诱导TBXT的可变剪接事件。
为了验证TBXT∆exon6亚型是否可以直接导致尾巴缺失,他们首先构建了一个Tbxt∆exon6/+杂合小鼠,这些小鼠的尾巴形态具有很强的异质性,有些没有尾巴,有些尾巴很短,63个杂合子小鼠中有21个有这些表型,说明TBXT∆exon6亚型的表达可以直接诱导尾巴缺失。
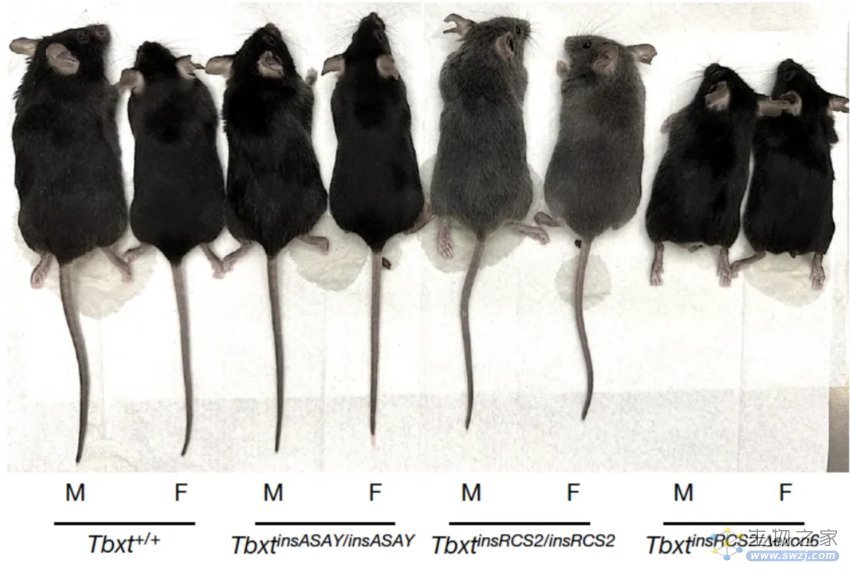
接下来他们将人类的AluY和AluSx1元件分别插入到小鼠Tbxt的第6个内含子和第5个内含子中,得到TbxtinsASAY小鼠;还选择了小鼠Tbxt的第5个内含子中与AluY等长的内源序列,将其反向互补序列插入到第6个内含子中,想得到TbxtinsRCS小鼠,但是没有成功,不过他们意外得到了另一个类似的小鼠品系,TbxtinsRCS2,其Tbxt的第6个内含子的220bp序列插入到了第5个内含子中。他们发现TbxtinsASAY小鼠并没有明显的表型,但是大约10%的纯合TbxtinsRCS2小鼠出现了短尾的表型。进一步分析发现,TbxtinsASAY小鼠仅表达非常低水平的TBXT∆exon6,而TbxtinsRCS2小鼠表达较高水平的TBXT∆exon6,因此TBXT∆exon6与全长Tbxt转录本的相对水平很关键,为了增加TBXT∆exon6的相对水平,于是他们将TBXT∆exon6/+杂合小鼠与TbxtinsRCS2小鼠杂交,得到的所有19个杂合TBXTinsRCS2/∆exon6小鼠都表现出尾巴完全缺失的表型,因此TBXT∆exon6转录本水平超过一定阈值时就可以抑制尾巴发育。
总的来说,这项研究揭示了人类进化过程中失去尾巴这一现象的遗传基础,帮助我们进一步理解了人类自身的进化过程。
原文链接:https://doi.org/10.1038/s41586-024-07095-8































