
人脑是人体中最复杂的器官。长期以来,探索人脑的结构、功能和发育过程一直是脑科学研究领域的焦点。为了揭示这一奥秘,科学界在付出了巨大努力的基础上先后建立了细胞、类器官和动物模型,用于生命和医学研究,大大提高了对人脑生理和病理过程的认识。
从结构上来说,人脑可以分为大脑、小脑、间脑和脑干。其中,小脑包含了人脑一半以上的神经元,是神经元密度最高的区域之一,并表现出独特的发育和衰老模式。值得一提的是,之前的工作已经揭示了体外小脑细胞的核形态特征,但其三维基因组结构仍有待揭示。
2023年9月7日,光遗传学之父 Karl Deisseroth 教授、谭隆志助理教授等人在 Science 期刊发表了题为:Lifelong restructuring of 3D genome architecture in cerebellar granule cells 的研究论文。
该研究构建了单个小脑颗粒细胞的第一个3D基因组结构,为人类和小鼠创建了跨物种的3D基因组图谱。该研究发现,小脑经历了一种非凡的、终身的3D基因组重构,这种重构在人类和小鼠之间是保守的,其量级远远大于大脑,这些结果为颗粒细胞在神经发育和衰老过程中的变化提供了有价值的新见解。

谭隆志,曾于2008年以第一名的成绩获第39届国际物理奥林匹克竞赛金牌,保送北京大学,一年后转学麻省理工学院(MIT)并于2012年获物理/生物双学位,此后在哈佛大学谢晓亮教授实验室获得博士学位。2019年,谭隆志因在人类单细胞基因组3D结构方面的研究获Science杂志和SciLifeLab颁发的2019年度Science & SciLifeLab青年科学家特等奖。
2019年,谭隆志加入光遗传学之父、斯坦福大学 Karl Deisseroth 教授实验室从事博士后研究。2022年12月,谭隆志加入斯坦福大学神经生物学系,任助理教授。

同一生物体内不同类型的细胞可以沿着高度不同的发育和衰老轨迹成熟。在分子水平上,细胞类型特异性基因转录可以通过基因组结构的多样性(例如染色体的三维折叠)来协调。然而,生命周期内的基因组结构尚未被阐明,这限制了我们对人脑功能及其疾病的生命周期细胞动力学的理解。
此前,谢晓亮、谭隆志等通过二倍体染色质构象捕获技术(diploid chromatin conformation capture,Dip-C)发现了前脑(大脑皮层和海马区)中的细胞在生命的第一个月经历了细胞类型特异性的转录组和基因组结构转化(Science,2018;Cell,2021)。然而,技术限制阻碍了这一发现在大脑区域、物种和寿命上的进一步扩展。
对于Dip-C的技术优势,谭隆志博士总结了三个方面:首先,Dip-C通过测量单细胞来解析三维基因组结构,揭示每个细胞独一无二的特性;其次,它完全基于生化反应实现了约100纳米的高分辨率,而无需借助光学显微镜等特殊昂贵的大型设备,并且生化反应效率较高,能够确保全基因组大部分DNA都能检测到;再者,Dip-C解析速度较快,一天可以完成数百个乃至上千个细胞,同时解析操作容易上手,成本低廉,易于推广。
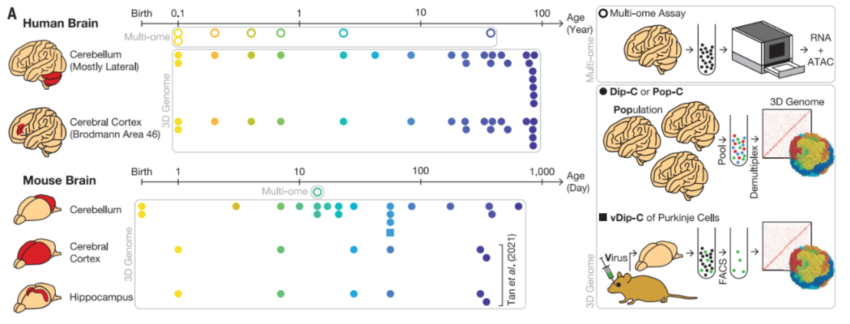
基于Dip-C技术测量单细胞的3D基因组结构
在这项最新论文中,研究团队将注意力转移到更广泛的神经轴上——从前脑到后脑——特别是小脑,由此扩展了在三维结构上的视野。小脑包含了人脑中大约80%的神经元,作为一个强大而紧凑的处理单元在进化过程中不断扩展,并表现出明显的特征,包括出生后发育延长、自闭症畸形和衰老过程中的退化。因此,了解小脑的基因组动力学可能有助于揭示小脑与运动控制和认知之间的联系。
研究团队通过Dip-C技术对人类和小鼠的小脑颗粒细胞进行了单细胞3D基因组测定。在群体规(Pop-C)和病毒富集(vDip-C)模式下,研究团队创建了一个高分辨率的、跨越人类和小鼠寿命的单细胞3D基因组图谱,并解析了细胞子集的3D基因组结构,以及测量了发育过程中的转录组和染色质可及性。
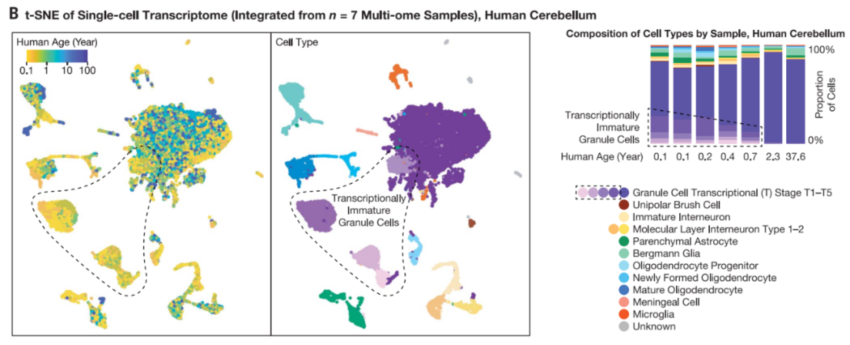
人类和小鼠的小脑颗粒神经元的跨寿命3D基因组图谱
研究团队发现,尽管小脑颗粒神经元的转录组和染色质可及性在出生后早期就成熟了,但3D基因组结构在整个生命过程中逐渐重塑。小脑颗粒细胞和中间神经元的连续体具有成熟的转录组和染色质可及性,由此揭示了在神经元中罕见的超长距离染色体内接触和特异性染色体间接触。这些结果揭示了意想不到的进化保守分子过程,这些过程是哺乳动物整个生命周期中神经发育和衰老的独特特征的基础。
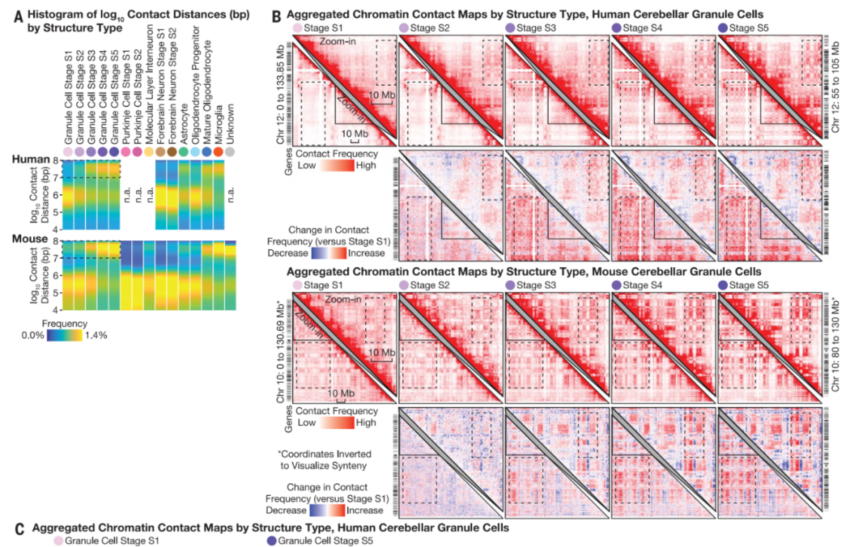
小脑颗粒细胞在发育和衰老过程中形成了超长距离的染色体内接触和特异性的染色体间接触
此外,为了测试这种基因组重组的稳健性,研究团队通过批量Dip-C探究了染色质重塑的功能扰动。他们发现,尽管存在功能扰动——例如颗粒细胞特异性的、纯合的Chd4缺失引起中度3D变化,但仍能实现稳健的3D基因组成熟。
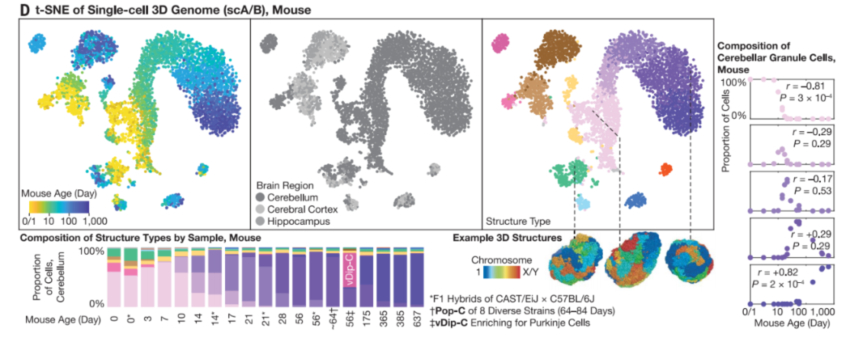
高通量、高精度的3D基因组分析表明人类和小鼠小脑的终身基因组重构
谭隆志博士表示,人类有两万多个基因编码蛋白质,这些基因在细胞中并不是行程简简单单一条直线排列,而是具有很复杂的空间结构。这项研究开发的3D基因组技术可以泛应用于许多大脑区域和身体组织,并可能有助于解决长期存在的挑战。
更广泛地说,该研究展示了对复杂的活组织进行跨生命跨度的3D基因组分析如何提供前所未有的信息维度,这种终生的结构转变可能为以前未确定的神经发育和衰老相关疾病的治疗靶点指明方向。
论文链接:
https://www.science.org/doi/10.1126/science.adh3253































