许多常见疾病,对男性和女性的影响是不同的。例如,自身免疫性疾病系统性红斑狼疮(SLE)和干燥综合征对女性的影响是男性的 9 倍,而精神分裂症对男性的影响频率和严重程度高于女性。对于系统性红斑狼疮,女性的发病率是男性的 7~9 倍。为何女性会高发?发表在 Nature 杂志的一篇研究发现,补体成分 C4 基因 C4A 和 C4B 的变异,与精神分裂症的风险增加有关,在具有共同 C4 基因型的个体中,产生 7 倍的 SLE 风险变异和 16 倍的干燥综合征风险变异[1]。
系统性红斑狼疮是一种累及全身多系统和器官的自身免疫病,其肾脏并发症狼疮性肾炎,是死亡风险增加的最强关联因素之一[2]。近年来随着诊治水平的不断提升,SLE 患者的预后得到显著改善[3]。
关于 SLE 在女性中发病率高于男性,要阐明这其中的原因,还要从已知的 SLE 发病机制讲起。
已知的 SLE 发病机制
SLE 的发病机制复杂,与遗传、性激素异常、环境因素相关,其发病常在细胞受损之后发生,如感染或严重日晒造成的细胞损伤,而一型干扰素(IFN-I)通路的激活和靶向核酸及核酸结合蛋白的自身抗体的产生,是 SLE 发病的起始事件。当先天和适应性免疫细胞继而激活并参与其中,在自身免疫反应中协同作用,机体便可发展为 SLE。
机体对于细胞损伤也具有清除机制。补体蛋白如 C4,将细胞碎片标记为垃圾,可以让机体快速清除细胞碎片。如果这些碎片没有被正确标记,则可能激活一型干扰素通路,并产生抗自身抗体。而相较于女性而言,男性体内的 C4 蛋白水平较高,这也就从一个层面解释了为何男性红斑狼疮的发病率低于女性[1]。
单基因突变造成促使 SLE 发生
目前的观点认为上述常见的多因素风险是造成 SLE 发病的原因,然而,一些罕见的单基因突变也可以造成严重的影响,促使SLE的发生,例如:
● 补体成分 C1q、C2、C4 基因突变或功能不足,与 SLE 的发生具有关联性[4];
● 部分 SLE 病人中发现了 TLR7 功能增强型突变[5];
● TREX1 功能不足,核酸累积驱动 cGMP-AMP 合成酶激活,进而促进 STING 依赖的一型干扰素的释放,引起狼疮样症状[6]。
SLE致病机制决定治疗方向
对 SLE 致病机制的了解,决定了治疗的方向,例如:
1、抑制一型干扰素系统,如:降解核酸复合物、抑制或消除 pDCs、抑制 TLR7 信号传导、阻断一型干扰素受体和抑制 JAK1/TYK2 信号传导等;
2、抑制或消除浆细胞,因为浆细胞可能产生核酸-自身抗体复合物,并将自身核酸抗原递送给内涵体 TLR7 受体,激活一型干扰素通路;
3、直接(BTK 抑制剂)或间接(BAFF 抑制剂)抑制 B 细胞分化;
4、新的治疗方法,如:CD19 CAR-T 细胞、靶向抗体直接靶向浆细胞治疗[4]。
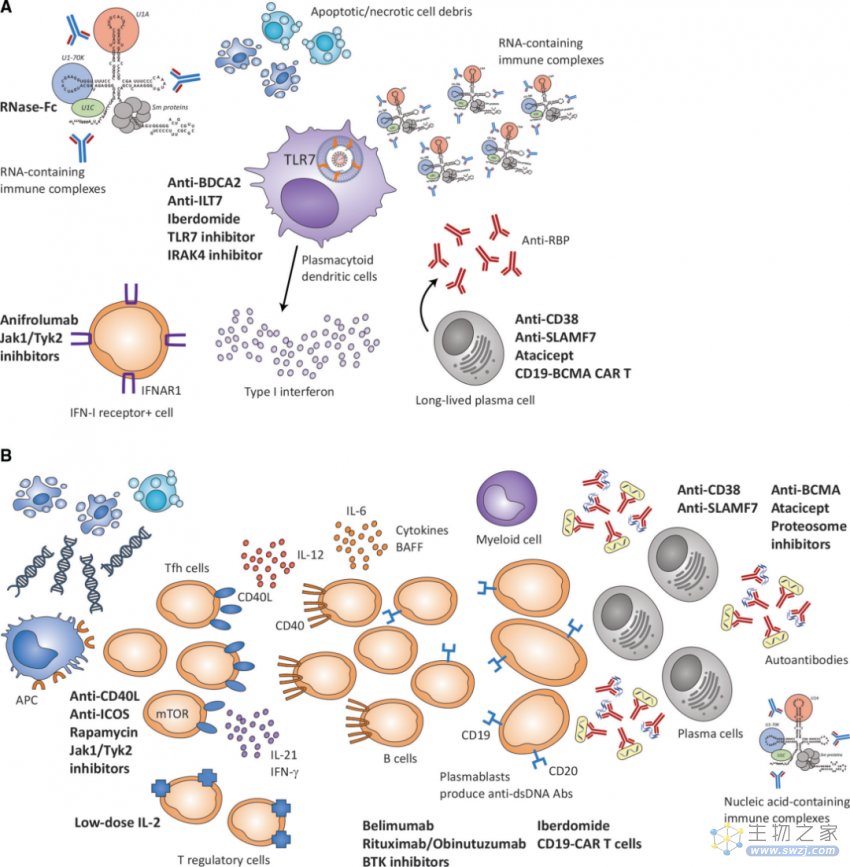
A. 靶向一型干扰素通路的治疗方案 B. 靶向适应性免疫系统治疗方案[4]
集萃药康动物模型助力 SLE 药物评价
集萃药康助力药物创新和研发,为临床前 SLE 药物评价提供动物模型和技术服务。
自免药物临床前一站式服务
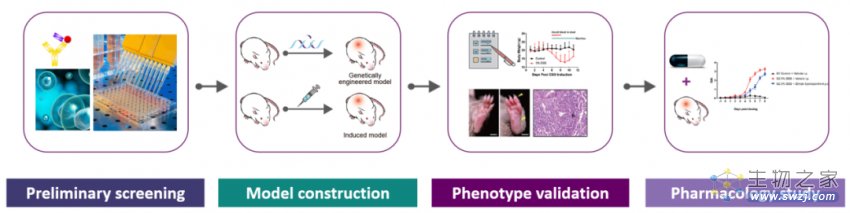
SLE 疾病小鼠模型资源
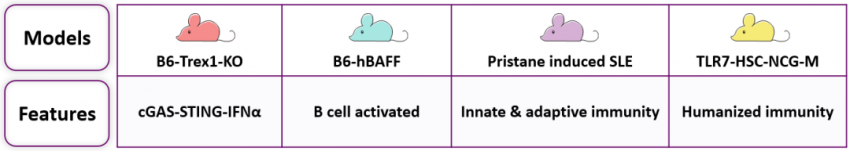
基于药物 MOA 的 SLE 模型选择
B6-Trex1-KO 小鼠
Trex1 敲除导致小鼠自身 DNA 积累,组成型激活 cGAS-STING 信号通路,诱发多器官炎症,心肌炎表型明显。该小鼠 Anti-dsDNA 水平显著高于普通 B6 小鼠,是 SLE 疾病机制研究和一型干扰素通路靶点药物筛选的理想模型。
B6-hBAFF 小鼠
转基因过表达人源 BAFF,该小鼠 Anti-dsDNA 水平显著高于普通 B6 小鼠,B 细胞显著激活和 IgA、IgG、IgM 等抗体水平升高,并且具有典型的狼疮肾炎表型。可应用于 B 细胞相关研究,亦适用于评价靶向B细胞的治疗药物。
Pristane 诱导 SLE 小鼠
降植烷(Pristane)诱导小鼠自身免疫反应产生 SLE 表型,B 细胞、一型干扰素通路被广泛激活,该模型使用范围较广泛。可以针对具体靶点,配合使用不同的基因人源化小鼠进行造模,进而用于评价各种抗体药物及小分子药物的临床前体内药效。
TLR7-HSC-NCG-M 小鼠
使用 TLR7 激动剂诱导 HSC-NCG-M(免疫系统重建小鼠),该小鼠具有人源免疫系统,诱导后的小鼠 Anti-dsDNA 水平升高,pDC 激活,出现面部/背部红斑和肾脏免疫复合物沉积,能够应用于评价治疗 SLE 的细胞类药物。
集萃药康开发了多种 SLE 小鼠模型,各个 SLE 小鼠具有独特的发病机制和疾病特征,以应用于不同的 SLE 研究方向,赋能 SLE 机制探索和创新药物发现!
参考文献:
[1]. Kamitaki N, Sekar A, Handsaker RE et al. . Complement genes contribute sex-biased vulnerability in diverse disorders. Nature. 2020 Jun;582(7813):577-581.
[2]. Kaul, A., Gordon, C., Crow, M. et al. Systemic lupus erythematosus. Nat Rev Dis Primers 2, 16039 (2016).
[3]. 王倬榕,任立敏,李茹,等. 系统性红斑狼疮20年生存率及预后因素分析[J]. 中华医学杂志,2019,99(3):178-182.
[4]. Kamitaki N, Sekar A, Handsaker RE et al. . Complement genes contribute sex-biased vulnerability in diverse disorders. Nature. 2020 Jun;582(7813):577-581.
[4]. Crow MK. Pathogenesis of systemic lupus erythematosus: risks, mechanisms and therapeutic targets. Ann Rheum Dis. 2023 Feb 15 :ard-2022-223741
[5]. Brown GJ, Cañete PF, Wang H et al. TLR7 gain-of-function genetic variation causes human lupus. Nature. 2022 May;605(7909):349-356.
[6]. Grieves JL, Fye JM, Harvey S et al. Exonuclease TREX1 degrades double-stranded DNA to prevent spontaneous lupus-like inflammatory disease. Proc Natl Acad Sci U S A. 2015 Apr 21;112(16):5117-22. doi: 10.1073/pnas.1423804112. Epub 2015 Apr 6.































