
异体器官移植是替代器官功能的有效途径,但受器官严重短缺的限制。尽管通过胚胎互补在其他大型哺乳动物体内产生人体器官将是一个突破性的解决方案,但它面临许多挑战,特别是人类细胞与受体组织的整合能力差。
2023年9月7日,中国科学院广州生物医药与健康研究院赖良学、戴祯、Miguel A. Esteban及潘光锦共同通讯在Cell Stem Cell 在线发表题为“Generation of a humanized mesonephros in pigs from induced pluripotent stem cells via embryo complementation”的研究论文,该研究发现通过胚胎互补诱导多能干细胞可以在猪体内产生人源化中肾。
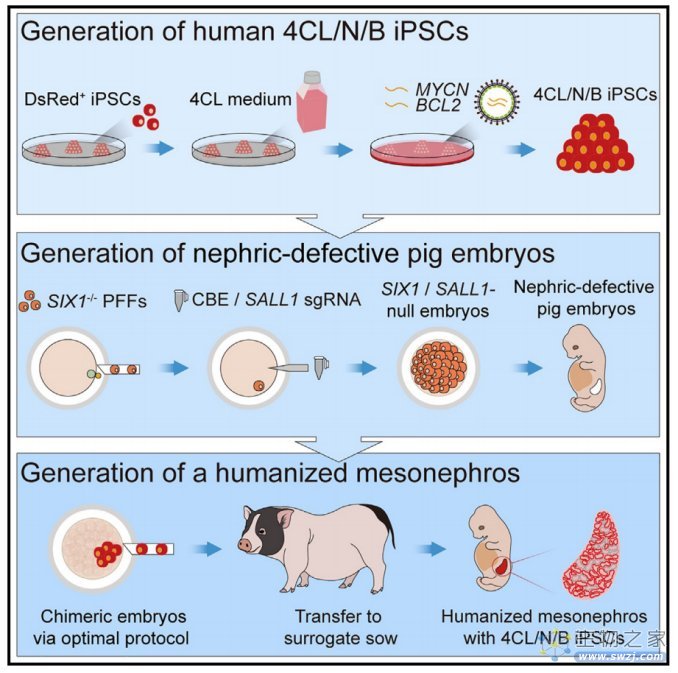
为了产生具有优越生态位内竞争力的人类细胞,作者将优化的多能干细胞培养条件与诱导过表达两种促生存基因(MYCN和BCL2)结合起来。所得到的细胞在种间嵌合囊胚的异种环境中具有显著提高的生存能力,并在缺乏SIX1和SALL1的肾缺陷猪胚胎中成功形成有组织的人-猪嵌合中期肾(mesonephros)结构,直至胚胎第28天。该研究证明了在器官发生障碍的猪身上产生人源化原始器官的可能性,为再生医学开辟了一条令人兴奋的途径,并为研究人类肾脏发育打开了一个人工窗口。

器官移植缺乏具有免疫组织相容性的供体是一个普遍存在的问题,没有直接的解决办法。一种有希望的替代方法是通过胚胎与多能干细胞(PSCs)的互补,产生具有人类组织的大型哺乳动物可存活的种间嵌合体,这种嵌合体可以接管通过基因编辑在宿主体内产生的特定器官发生缺陷的生态位。老鼠和大鼠之间已经成功地实现了胰腺、胸腺、肾脏等器官的种间器官发生。鉴于猪在生理和器官大小以及胚胎发育方面与人类相似,猪是培育人体器官的极具吸引力的目标。然而,获得与啮齿类以外的哺乳动物物种的高度嵌合一直是一个挑战。虽然已经在ETV2或MYF5/MYOD/ MYF6缺失的猪胚胎中产生了人内皮和骨骼肌组织斑块,但由于人PSCs来源的细胞对猪组织的总体贡献较差,迄今为止还没有产生实体器官。
种间嵌合率低的主要原因有两方面:(1)胚泡内和组织壁龛内与供体细胞的竞争;(2)供体人PSCs来源细胞和宿主细胞之间的发育状态差异,这阻碍了同步发育进程。注射的PSC中促生存途径的激活可用于通过拮抗细胞竞争诱导的细胞凋亡来促进嵌合体作用。与单因子过表达相比,MYCN和BCL2 (N/B)的组合极大地增强了小鼠、兔和猪胚胎的生态位内竞争力。此外,最近开发了一种新的培养基,允许人类PSCs逐步回退到早期发育阶段,在转化过程中没有明显的基因组稳定性问题。该培养基(4CL)在胚胎10.5天(E10.5)允许高达1%的人小鼠嵌合,这与过度表达抗凋亡因子的引物PSCs的整合效率相当。
机理模式图(图源自Cell Stem Cell)
人体肾脏是世界上移植最多的实体器官之一,也是最早出现在胚胎发生过程中的器官之一。它经历顺序的前肾、中肾和肾间肾规范。前肾和中肾的形成和消退得到了很好的协调,随后输尿管芽侵入肾间充质,从而启动肾间充质的形成。研究表明,SIX1调节中肾小管(mesonephroi)形成和输尿管芽分支的后肾形成,,而SALL1维持后肾间质中肾元祖细胞和新生肾元。因此,作者假设,对SIX1/ SALL1缺失的猪胚胎进行工程改造,将产生从早期中肾到晚期后肾的肾脏缺陷生态位,这可能使人类PSCs填补整个肾脏发育程序。
该研究借助具有高分化潜能,强增殖及抗凋亡能力的早期胚胎样人源多能干细胞在多基因修饰的器官缺陷猪模型体内再生了人源中肾。在世界范围内首次证明了借助胚胎补偿技术实现实质性功能器官异种体内再生的可行性。这一重要突破不仅为人源器官异种体内再生奠定了重要的理论及技术基础,也将为未来解决供体器官短缺这一世界级难题提供了极大价值。































