观察到黑素细胞干细胞在毛囊中上下迁移,分化成黑素细胞,然后又回到干细胞的身份,这让人们对长期以来关于成人干细胞的假设产生了质疑。
作者在两年内观察了单个毛囊中的单一黑色素细胞干细胞(McSCs)。他们发现,对于成人干细胞来说,McSCs有一种独特的生活方式,在毛囊中上下游走。他们的工作可以解释为什么头发变白是衰老的最早迹象之一。
哺乳动物组织中的成人干细胞群通常被描述为固定的,居住在一个被称为利基的固定位置,在那里它们产生了被称为 "过境复制 "的后代细胞。这些细胞会增殖并迁移到需要它们来补充组织的地方。到目前为止,研究人员认为McSCs也遵循这一模式,停留在由两个结构组成的区域内,即毛囊上部的隆起和底部的毛胚,并产生黑色素细胞,在头发生长的活跃阶段(anagen)迁移到毛囊的底部,为头发提供色素。这个完全合理的模型是基于对许多毛囊在不同时间点的成像观察。
在他们的工作中,Sun和他的同事们使用血统追踪(一种细胞标记的方法,随着时间的推移追踪一个细胞及其后代)和眼内成像(在这种情况下,对活体小鼠的同一个皮肤点反复进行成像)的组合来追踪McSCs。他们观察到,正如预期的那样,小鼠McSCs在毛发生长周期的静止期(休止期)驻扎在毛发胚芽和隆起部位。然而,在生长期,它们向生长中的毛囊底部移动,然后再向上迁移到隆起部,然后回到它们在毛胚中的原始位置(图1)。
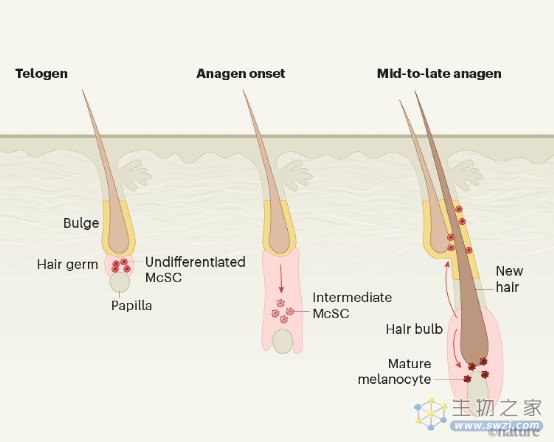
Sun等人发现,当McSCs移动到卵泡底部时,它们也开始了分化程序,采用了表明分化的黑色素细胞的形状。接下来,该小组使用单细胞RNA测序来分析迁移细胞的基因表达谱。这项分析显示,McSCs在迁移到卵泡底部时开始表达分化的标记,并显示出成熟黑素细胞的一些特征(如色素沉着)。值得注意的是,这些细胞随后逆转了这一程序,在隆起处重新分化为干细胞。研究人员发现,McSCs可以继续这种循环至少两年--大约是小鼠的成年寿命。
这些迷人的数据表明,McSCs的行为与之前描述的成人干细胞群不同。几乎没有证据表明任何其他干细胞能从它们的生态位物理迁移到另一个地方,然后再回来。一项研究报告了肠道干细胞的类似行为,但它们没有迁移得那么远,也没有发展退步。也有证据显示,毛囊干细胞在老化和伤口愈6期间迁移出隆起部位,但在这两种情况下,这些细胞都没有返回其利基。
事实上,McSCs的发育灵活性也许比它们的物理运动更令人惊讶。在肝脏和胰腺等器官的再生过程中,有分化细胞脱分化的例子。而在一些实验环境中,成体干细胞的缺失会导致转运增殖细胞的去分化,从而使干细胞库再生。然而,成人干细胞在生理环境中分化然后再去分化的想法是闻所未闻的。这一发现质疑了该领域的一个教条--细胞总是采取逐步分化的状态,除非该系统被伤害或癌症破坏。
Sun等人接下来研究了控制McSC周期的细胞信号通路。Wnt信号通路与黑色素细胞的产生有关,因此作者追踪了基因工程小鼠品系中的McSCs,在该品系中该通路处于亢奋状态。McSCs中Wnt信号的增加诱导它们分化成黑色素细胞,并阻止细胞在隆起处分化。作者表明,激活McSCs的Wnt信号来自毛胚和隆起部的周围细胞--通过基因抑制这种细胞间的信号传递,防止McSCs分化。
黑色素细胞的产生也受到阳光的刺激。伊藤和他的同事发现,用紫外线照射小鼠皮肤会增加黑色素细胞的色素生成。但是,同样,黑色素细胞保留了溜回未分化的McSCs的能力。
最后,作者问道,McSC的行为是如何受到衰老的影响的--这个问题与我们这些有白发的人有关,白发是由缺乏色素引起的。对老年小鼠毛囊的分析显示,McSC的转运能力减弱,这意味着产生的黑色素细胞减少,从而使新的毛发轴变白。这一发现可能为新的治疗方法打开大门,通过提高McSC的活性来防止变灰。
值得注意的是,McSCs被认为是黑色素瘤的关键角色,这是一种威胁生命的癌症。Sun等人认为,他们观察到的发育可塑性可能解释了黑色素瘤如此难以治疗的原因。还有一个有趣的推测是,头发变白是衰老的最初迹象之一,可能是因为McSCs产生后代的方式,比其他干细胞的物理要求更高。这意味着该细胞只是更早地被耗尽。然而,McSCs的过早老化可能是一种防止黑色素瘤形成的进化策略-如果细胞停止复制,它们就不能获得导致癌症的突变。
这项研究中的不寻常观察是可能的,因为作者的创新方法使他们能够长期监测其生态位中的相同细胞。展望未来,类似的技术应尽可能地应用,以重新审视其他成人干细胞群的行为。也许这种摇摆不定的行为终究不是那么不寻常。
原文链接:https://www.nature.com/articles/s41586-023-05960-6































