痛经在女性群体中广泛存在,但10%-15%的育龄妇女会因为子宫内膜异位症(Endometriosis,简称“EMs”),在月经期间感受到剧烈疼痛。作为一种常见妇科疾病,EMs的病因至今仍是未解之谜。目前,已经提出了几种假设来解释子宫内膜异位症的原因,包括月经逆行、体腔化生和苗勒管残余物的存在。月经逆行(经血没有从阴道流出,而是流回输卵管,并进入盆腔)是EMs的公认原因。然而,大多数育龄妇女都经历过月经逆行,但只有10%-15%的妇女患上EMs,这表明存在促进EMs发展的其他机制。

EMs是指本当存在于子宫内的内膜组织,却在子宫外的其他地方生长,最常见于盆腔腹膜、输卵管以及卵巢,主要的症状有骨盆腔疼痛以及不孕。有七成的疼痛感发生在经期,性交时产生疼痛感也很常见,有五成的病人更是罹患了不孕症,少数的病患有排尿或肠部分的病征,约25%的患者没有任何症状。
长期以来,临床认为子宫腔几乎是无菌的,但EMs和子宫内膜炎症之间存在显著关联,炎症与细菌又密不可分。作为连接子宫的通路,阴道中的大部分细菌是乳杆菌,但当阴道生态失调时,也可检测到其他细菌,如具核梭杆菌。已知梭杆菌属的物种是口腔和胃肠道微生物群的常见成员,且长期以来一直被认为是机会性病原体。但最近的研究表明,某些梭杆菌属物种(例如具核梭杆菌)不仅在牙周炎中发挥重要作用,而且通过诱导多种炎性细胞因子如TGF-β,在致癌作用中发挥重要作用。
EMs的生长是良性的,但大量的促结缔组织增生性基质在临床上存在问题,其分泌的生长因子会促进成纤维细胞的强烈增殖和迁移。这些基质成纤维细胞是EMs进展的关键决定因素。活化的肌成纤维细胞含有细胞质微丝相关蛋白,如转运蛋白(TAGLN)、波形蛋白(VIM)和α-平滑肌肌动蛋白(αSMA)。从静止的成纤维细胞到活化的肌成纤维细胞的转变,是由慢性炎症引发的,慢性炎症涉及多种细胞因子的产生。例如,在伤口愈合和慢性炎症(如纤维化和癌症)过程中,静止的成纤维细胞可被激活分化成肌成纤维细胞。那么,EMs与阴道梭杆菌带来的炎性细胞因子有关系吗?
6月14日,日本名古屋大学研究团队在Science Translational Medicine发表题为“Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts”的研究成果。此项研究确定了子宫内膜异位症的潜在致病因素:梭杆菌感染。

图1 研究成果(图源:[1])
研究人员设计了一系列研究,以确定TGF-β诱导的子宫内膜成纤维细胞表型转变导致EMs发生的机制,并验证子宫内膜梭杆菌感染促进这些表型转变的假设。首先,在人类中设计了一项观察性研究,以确定EMs患者子宫内膜成纤维细胞特异性表达的基因;然后,设计了一项对强烈表达TAGLN的人子宫内膜成纤维细胞的功能研究;之后,继续研究上游靶点,以确定表型转变是否是由TGF-β以及梭杆菌感染后的全身和局部炎症反应引起的;最后,设计了小鼠体内实验,以确定梭杆菌感染是否促进小鼠EMs的发展,并探索抗生素作为EMs非综合治疗的有效性。
结果发现:
01
EMs患者肌成纤维细胞TAGLN基因表达上调,促进增殖
TAGLN作为钙调蛋白家族的肌动蛋白交联蛋白起作用,并且是肌成纤维细胞的标志物。基因表达谱分析结果表明相对于正常子宫内膜组织,EMs样本中有10个基因上调,3个基因下调。在这13个基因中,只有TAGLN的表达显著增加。过度表达TAGLN会肌成纤维细胞的增殖、迁移和附着。
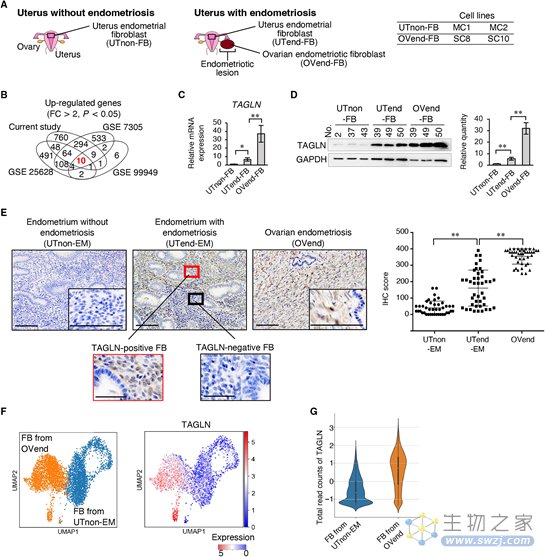
图2 来自EMs患者的TAGLN上调(图源:[1])
02
TAGLN通过IL-6促进子宫内膜细胞增殖
肌成纤维细胞在收缩时会产生并分泌多种细胞因子。通过检查TAGLN表达相关的细胞因子,发现IL-6在蛋白质阵列上测试的30种细胞因子和生长因子中最为突出。添加IL-6促进了EMs相关细胞增殖。在临床样本中,EMs患者来源样本的IL-6表达显著增加,TAGLN的蛋白表达与这些组织中的IL-6呈正相关。
03
TGF-β1诱导TAGLN的表达
TGF-β1是在EMs中起主要作用的关键生长因子,TGF-β1通过与其启动子结合的sma和mad相关(SMAD))诱导肌成纤维细胞相关基因,包括TAGLN。相对于正常子宫内膜,EMs患者组织中基质细胞和上皮细胞中TGF-β1和TGF-β受体1(TGF-βR1)的丰度均增加。体外实现表明TGF-β1上调细胞中TAGLN的表达,而SB431542可消除这种上调。SB431542是SMAD2/3介导的信号转导的特异性抑制剂。这些发现表明,表观遗传调控参与了通过TGF-β信号从静止成纤维细胞向肌成纤维细胞的转变。
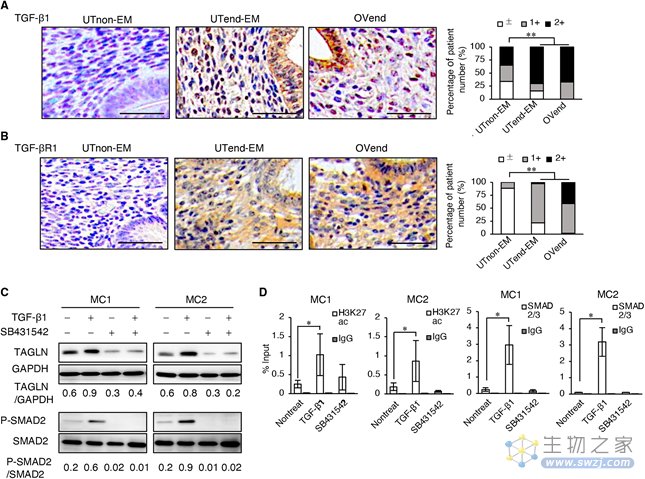
图3 TGF-β1在体外诱导TAGLN的表达(图源:[1])
04
梭杆菌感染影响子宫内膜微环境
子宫内膜微环境中TGF-β的丰度可能与细菌感染有关。与健康患者相比,五种细菌属在EMs患者的子宫内膜中显著增加。在这些细菌属中,排名低第一的Erysipelothrix在患有或不患有子宫内膜异位症的个体的子宫内膜组织中,均未大量存在。排名第二梭杆菌在EMs患者的组织中,显著高于对照组,且浸润EMs患者子宫内膜的细菌主要是具核梭杆菌。
具核梭杆菌可通过其膜脂多糖诱导先天免疫反应,数量增加的CD163阳性M2巨噬细胞可产生TGF-β1,而巨噬细胞是子宫内膜异位病灶内最丰富的免疫细胞。与对照组相比,浸润子宫内膜组织的巨噬细胞和TGF-β1数量显著增加。体外试验表明,即使是热灭活的具核梭杆菌也能促进M2巨噬细胞形成,并刺激产生TGF-β1。这些数据表明子宫内膜中的具核梭杆菌可能通过上调TGF-β1信号影响成纤维细胞中TAGLN的丰度。
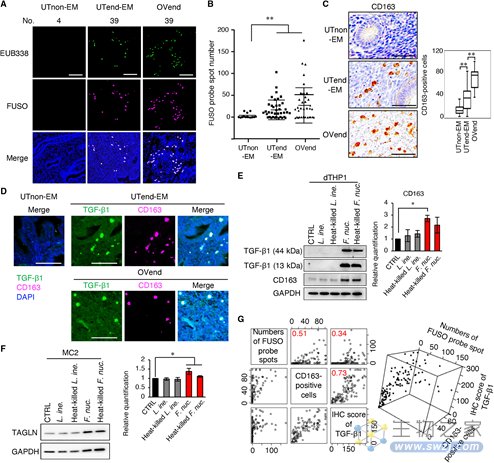
图4 梭杆菌感染影响子宫内膜的微环境(图源:[1])
05
具核梭杆菌感染促进EMs,抗生素治疗可缓解
通过小鼠阴道感染具核梭杆菌的体内实验,表明TAGLN蛋白在具核梭杆菌感染后的子宫内膜异位症中的表达。两种不同类型的抗生素甲硝唑(MZ)和氯霉素(CP)对具核梭杆菌敏感,在供体小鼠感染后每天经阴道给药,持续5天。经过一周的抗生素治疗后,具核梭菌浸润不再存在,供体小鼠子宫内膜和受体小鼠子宫内膜异位病变中的M2巨噬细胞浸润、TGF-β1和TAGLN表达均降低。MZ或CP抗生素治疗可能有助于治疗子宫内膜异位症。
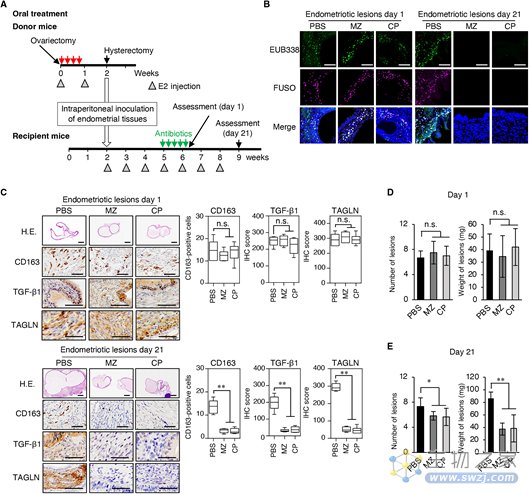
图5 根除具核梭菌的抗生素治疗可减少小鼠子宫内膜异位病灶的重量(图源:[1])
这项研究通过证明子宫内膜的梭杆菌感染可能导致疾病,进一步了解了EMs的发病机制:梭杆菌感染激活TGF-β信号,诱导TAGLN表达,促进异位子宫内膜细胞增殖。梭杆菌优先感染部分患者子宫内膜的原因尚不明确。研究表明,由于口腔内具核梭杆菌的血源性传播,导致宫内感染。这种传播主要发生在怀孕期间,此时流向胎盘的血流量普遍增加。由于EMs患者通常未生育,因此也可以考虑通过阴道传播。
目前,EMs的治疗为激素疗法,例如长期排卵抑制,不仅有副作用,还使女性在治疗期间不能怀孕。顽固性盆腔疼痛通常需要手术治疗,但手术切除子宫内膜异位病灶后,高复发率是大概率问题。此项研究揭示了EMs的潜在致病机制,并用MZ或CP根除,可能是改善这种疾病治疗的一种选择。因此,将抗生素与激素治疗等其他疗法相结合可能是另一种有效方法,有望在未来的临床试验中得到检验。
这项研究有一些局限性。首先,该研究缺乏直接证据支持子宫内膜中梭杆菌的存在促进逆行月经后EMs的假设。许多研究记录了导致EMs的机制,因此需要进一步的精确研究;其次,需要进行临床研究,以确定针对梭杆菌的抗生素治疗是否对EMs患者真正有效。
参考文献:
[1] Ayako Muraoka, Miho Suzuki, Tomonart Hamaguchi, et al. , Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts.Sci. Transl. Med.15,eadd1531(2023).DOI:10.1126/scitranslmed.add1531































