细胞衰老是机体衰老和癌症的标志之一,它是一个动态的生物学过程,能够稳定的阻止损伤细胞或者癌变细胞的增殖。癌基因诱导的衰老(oncogene-induced senescence, OIS)会导致细胞退出正常的细胞周期,这是由一些抑癌基因来调控,比如p53和p16,这个过程阻止了这些损伤细胞发展为肿瘤细胞【1,2】。
衰老细胞在面对不同的环境压力时会分泌许多细胞因子、趋化因子、蛋白酶或者其他生物活性分子,共同组成衰老相关分泌表型(senescence-associated secretory phenotype, SASP)【3,4】。这些因子能够招募免疫细胞清除衰老细胞,阻止衰老细胞向肿瘤细胞的发展。但是,当衰老细胞不断增加时,SASP的大量增加反而会对组织结构和功能产生伤害,导致一些衰老相关病变的发生,也包括癌症。因此,衰老细胞和肿瘤细胞共同进行皮下成瘤实验时,反而促进了肿瘤的发展【5】。不过,在体内研究中,因为缺乏特异性的标记基因,衰老的相关研究陷入困境。目前,对于衰老细胞的鉴定,主要是通过CDK(cyclin-dependent kinase)抑制因子p16或者p21的表达升高来确定【6】。已有研究显示,小鼠肿瘤模型中有p16表达细胞的出现,但这些衰老细胞通过怎样的机制调控肿瘤发展还是未知的。
2023年6月1日,来自美国梅奥医学中心的Darren J. Baker带领团队在Cancer Cell杂志发表了文章Senescent alveolar macrophages promote early-stage lung tumorigenesis,他们通过小鼠自发成瘤模型鉴定了肿瘤发展中的一群衰老细胞——一个特殊的巨噬细胞亚群,这群衰老细胞对于肿瘤发展至关重要,靶向抑制这群衰老细胞的发展能够抑制肿瘤细胞的进展。

研究人员选用了KrasG12D突变自发成瘤小鼠检测衰老细胞,发现在肺部病变组织中,衰老相关基因p16、p21以及OIS标志基因Dec1,促炎因子Il6、Tnfα、Tgfβ等都表达升高,说明Kras肺部病变组织中有衰老细胞的产生,这个结果也通过SA-β-Gal(senescence-associated β-galactosidase)实验得到了验证。
研究人员构建了p16敲除小鼠并与Kras小鼠杂交,发现p16敲除后肺部病变形成变少了,说明p16表达的细胞可能促进了Kras小鼠肺部病变的形成。接下来,研究人员构建了一种转基因小鼠,命名为INK-ATTAC,这种小鼠采用AP20187(AP)干预时能够选择性清除p16阳性衰老细胞。研究人员构建了INK-ATTAC和Kras小鼠的杂交鼠,通过AP干预选择性清除p16阳性细胞,发现AP处理减少了Kras小鼠病变区域SA-β-Gal阳性细胞的数量以及p21阳性衰老细胞的数量。
另外,由于肿瘤细胞以及衰老细胞大量表达BCL2家族蛋白,进而产生了促增殖抑制凋亡的表型,因此它们对ABT263比较敏感。分别对野生小鼠以及ATTAC; Kras小鼠使用ABT263,能够在小鼠肺部病变组织引起细胞凋亡,减少腺瘤的数量,其作用效果与AP作用效果相当。不过,联合使用ABT263和AP并没有引起更多的腺瘤减少效果,其效果与单独使用两种药物相当,说明这两种药物的作用都是通过清除衰老细胞来实现的。这个结果在p16或者p21敲除小鼠中得到了同样的验证。这些实验结果都表明,衰老细胞促进了肿瘤的进展,清除这些衰老细胞能够抑制肿瘤的进展。
接下来,研究人员试图鉴定这群衰老细胞的具体类别。首先研究人员发现,AP处理明显降低了含有X-Gal的免疫细胞的数量。紧接着,研究人员对Kras小鼠的肺部病变组织进行了单细胞测序。结果显示,组织驻留的肺泡巨噬细胞(alveolar macrophages, AMs)具有高水平的Cdkn2a(p16)表达,这群细胞同时具有Siglec-F+、Marco+、Mrc1+、Cd80+、Itgax+和Adre1+的特征。其它类型巨噬细胞以及其它免疫细胞中Cdkn2a表达水平都比较低。
进一步的单细胞测序分析显示,AMs中cluster 2/3中p16的表达水平最高,同时,这两群细胞中也表达一些SASP相关基因,比如Spp1、Igf1、Ctsd以及Ctsb等,另外,这两群细胞中也表达一些和衰老相关的基因,比如增殖负调控基因Ctnnb1等。这些结果表明,这两群组织驻留巨噬细胞是在肿瘤中发挥重要作用的关键衰老细胞。
研究人员还通过分析单细胞测序数据,找到了这两群细胞中特异表达的一个细胞表面因子CXCR1。通过免疫荧光试验发现,在肺部病变形成的早期,CXCR1高表达细胞便开始出现并扩增,AP处理或者p16敲除都降低了CXCR1高表达细胞系的数量,减缓了肺部病变的程度。另外,研究人员还发现,自然衰老的小鼠中,CXCR1高表达巨噬细胞数量在不断增加,CXCR1可作为衰老巨噬细胞的一个marker。
最后,研究人员发现,清除CXCR1高表达衰老巨噬细胞能够促进细胞毒性T细胞的增殖,进而抑制肿瘤的进展。
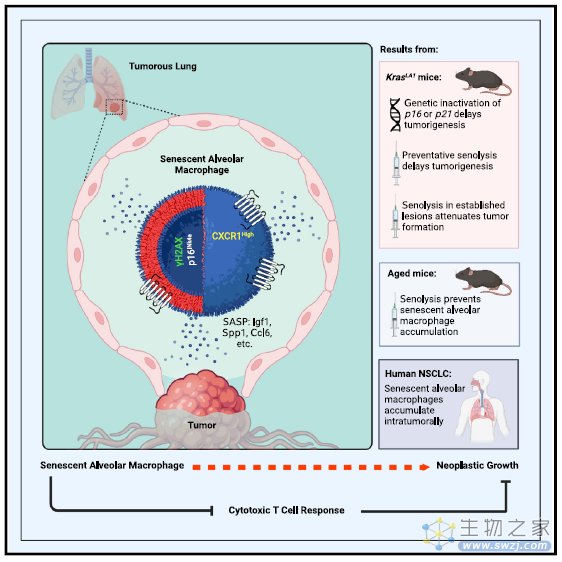
综上所述,研究人员鉴定了肿瘤发展过程中关键的一群衰老巨噬细胞,这群巨噬细胞具有CXCR1高表达的特性,能够抑制细胞毒性T细胞的增殖,促进肿瘤进展。靶向清除这群衰老巨噬细胞能够抑制肿瘤的进展,为肿瘤治疗提出了新的策略。
原文链接:
https://doi.org/10.1016/j.ccell.2023.05.006
参考文献
1. Serrano, M., Lin, A.W., McCurrach, M.E., Beach, D., and Lowe, S.W. (1997). Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a. Cell 88, 593–602.
2. Xue,W., Zender, L.,Miething, C., Dickins, R.A., Hernando, E., Krizhanovsky, V., Cordon-Cardo, C., and Lowe, S.W. (2007). Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas. Nature 445, 656–660.
3. Sturmlechner, I., Zhang, C., Sine, C.C., van Deursen, E.J., Jeganathan, K.B., Hamada, N., Grasic, J., Friedman, D., Stutchman, J.T., Can, I., et al. (2021). p21 produces a bioactive secretome that places stressed cells under immunosurveillance. Science 374, eabb3420.
4. Tasdemir, N., Banito, A., Roe, J.S., Alonso-Curbelo, D., Camiolo, M., Tschaharganeh, D.F., Huang, C.H., Aksoy, O., Bolden, J.E., Chen, C.C., et al. (2016). BRD4 connects enhancer remodeling to senescence immune surveillance. Cancer Discov. 6, 612–629.
5. Liu, D., and Hornsby, P.J. (2007). Senescent human fibroblasts increase the early growth of xenograft tumors via matrix metalloproteinase secretion. Cancer Res. 67, 3117–3126.
6. Liu, J.Y., Souroullas, G.P., Diekman, B.O., Krishnamurthy, J., Hall, B.M., Sorrentino, J.A., Parker, J.S., Sessions, G.A., Gudkov, A.V., and Sharpless, N.E. (2019). Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proc. Natl. Acad. Sci. USA 116, 2603–2611.































