在现代社会,由于人口老龄化加剧、环境污染恶化和生活习惯改变等复杂因素的影响,全世界范围内的癌症发病率逐年上升。值得注意的是,代谢改变是癌症的一个重要标志,它可以支持癌细胞的功能,比如在各种应激状态下的快速增殖和存活。
最近的许多研究发现,某些代谢活动在防止有毒代谢中间体的积累方面具有重要的解毒作用。更重要的是,一个名为“kitchen sink”(直译:厨房水槽)的研究模型已经被观察到。在这个模型中,解毒酶只有在产生有毒代谢物的细胞中才需要,就像只有水龙头打开时的厨房水槽才需要排水管一样。
2023年10月25日,美国麻省大学医学院的 Dohoon Kim 团队在国际顶尖学术期刊 Nature 上发表了题为:Disruption of sugar nucleotide clearance is a therapeutic vulnerability of cancer cells 的研究论文。
该研究通过对条件必需代谢酶的CRISPR-Cas9基因筛选发现,UXS1——一种定位于高尔基体上的代谢酶,可以将UDP-葡萄糖醛酸(UDPGA)转化为UDP-木糖,并且UXS1仅在表达高水平的上游酶UGDH的细胞中才是必需的。
更重要的是,UGDH在包括肺腺癌在内的多种癌症中高表达,并在化疗耐药选择过程中进一步增强。因此,这些癌细胞选择性地依赖于UXS1进行UDPGA解毒,由此揭示了高表达UGDH的肿瘤的一个潜在治疗靶点。

细胞在代谢过程中,不可避免地产生一些有害代谢物,因此需要专门的解毒酶来将这些有害代谢物清除掉。在肿瘤细胞中,代谢改变使得特定的有害代谢物过度积累,因此对应的解毒酶也成为了这些肿瘤细胞的条件必需基因。
在这项最新研究中,Dohoon Kim 团队使用DEPMAP癌细胞系依赖性数据库来识别具有不同重要性的代谢酶,这些代谢酶是某些癌细胞系生存所必需的,而其他癌细胞系则不需要。通过使用 kitchen sink 模型,研究团队发现,高尔基体酶UXS1很可能是特定肿瘤类型中的条件必须酶。
为了确认这一点,研究团队在19种不同组织来源的癌细胞系中对UXS1进行了CRISPR-Cas9基因敲除。这些癌细胞系具有不同水平的UGDH mRNA表达,但研究结果显示,UXS1的缺失仅对高表达UGDH的细胞系有害。
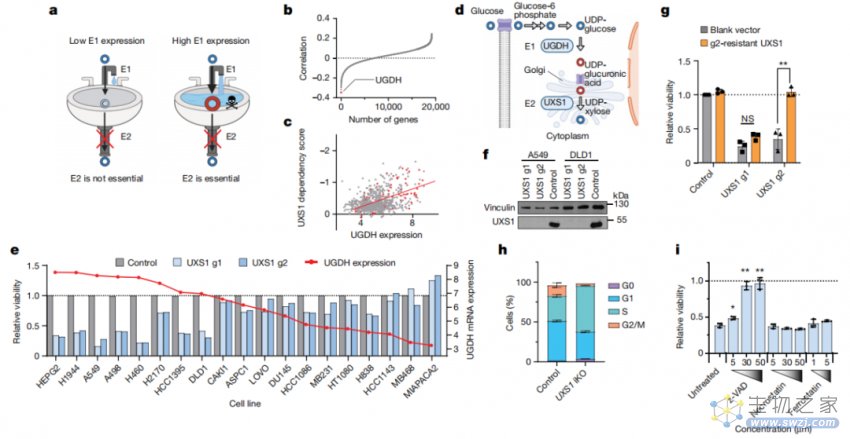
UXS1对细胞存活至关重要,与上游酶UGDH的细胞系特异性表达相关
UGDH是一种NAD+依赖性酶,可催化UDP-葡萄糖(UDP-Glc)的双重氧化以产生UDP-葡萄糖醛酸(UDPGA)。值得一提的是,UXS1是UGDH的下游相关酶,它可以将UDPGA转化为UDP-木糖,防止由UGDH产生的UDPGA的过量积累。
接下来,研究团队通过液相色谱-质谱(LC-MS)在UXS1敲除的细胞系中测量了UDPGA的水平。正如预期的那样,UXS1敲除后会以时间依赖性的方式导致UDPGA的过度积累,大约是正常水平的70倍!不仅如此,UDPGA积累意味着UDP-木糖的减少,导致细胞内木糖修饰的损失。
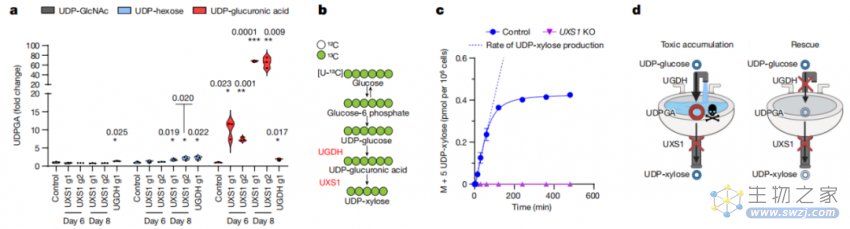
UXS1敲除导致UDPGA的过量积累
进一步研究表明,过量的UDPGA破坏了高尔基体的形态和功能,阻碍了表皮生长因子受体等表面受体向质膜的运输,并降低了细胞的信号传导能力。此外,UDP-木糖的减少导致UGDH的活性的增强,进一步加剧了UDPGA的过量积累。
简而言之,UXS1酶不仅可以通过代谢反应清除UDPGA,还可以通过对UGDH酶的负反馈抑制减少UDPGA的产生。
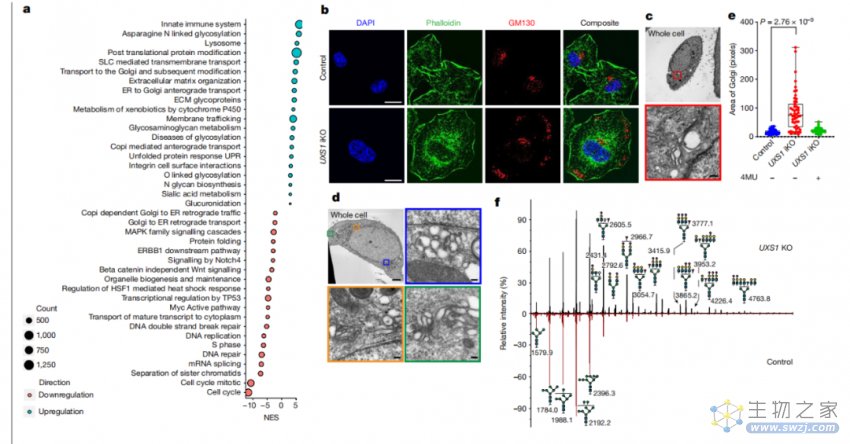
UDPGA的积累会导致高尔基体功能障碍,从而导致EGFR信号通路失活
更重要的是,研究团队还证明了UXS1-UGDH轴对癌症治疗具有重要意义,因为许多类型的癌细胞相对于健康细胞具有高水平的UGDH,并且这一特征在化疗耐药选择过程中进一步增强。论文通讯作者 Dohoon Kim 博士表示,UXS1可能是治疗UGDH高表达的癌症的有潜力的新靶点!
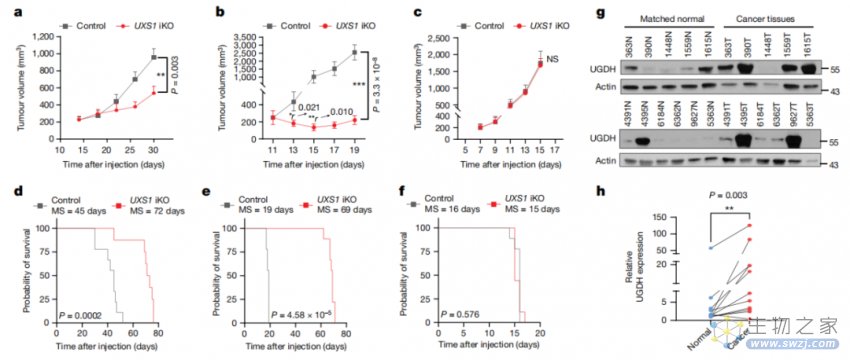
UXS1是一种癌症选择性治疗靶点,因为UGDH在癌症亚群和化疗耐药癌细胞中的表达升高
此外,这项研究还揭示了糖核苷酸代谢途径和信号转导过程调节之间的意想不到的联系。因此,高水平UDPGA除了可以直接“毒杀”癌细胞,还可以通抑制信号传导过程沉默癌细胞,使其不能对细胞外信号做出反应,增强癌症治疗的效果。这一概念可能与细胞生物学广泛相关,并在癌症治疗之外的多种健康环境中得到应用。
论文链接:
https://www.nature.com/articles/s41586-023-06676-3































