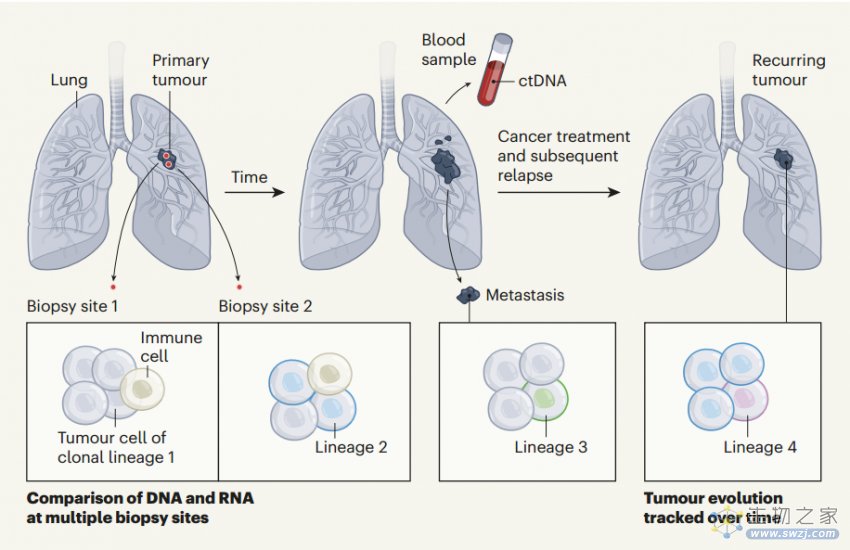
肺癌是全球癌症相关死亡的主要原因,但人类尚缺乏对这一疾病背后生物机制的全面理解。近日,《自然》杂志及旗下《自然・医学》杂志刊发了一系列TRACERx计划新结果,这是一项持续收集非小细胞肺癌(NSCLC)患者综合基因组数据和临床数据的大型研究项目,从诊断到治疗全面揭秘NSCLC,对NSCLC的自然史提供了最全面的描述。共计7篇论文包括肺癌如何进化、扩散、对治疗耐药、预测预后等等主题。
· 肺癌的演变
这项研究[1]分析了在手术中或随访期间从预期参加TRACERx研究的第一批421名非小细胞肺癌患者中取样的1644个肿瘤区域。研究试图找到不同亚克隆的驱动优势和与临床结局之间的关系。
在肺腺癌中,40个常见癌症基因中的22个的突变处于显著的亚克隆选择之下,包括典型的肿瘤起始基因如TP53和KRAS。尽管患者有吸烟史,8%的肺腺癌缺乏烟草诱导突变的证据。与从不吸烟的肿瘤患者相比,这些肿瘤的EGFR突变和RET、ROS1、ALK和MET致癌亚型的检出率相似,这表明它们具有相似的病因和发病机制。亚克隆扩增与选择优势有关,在肿瘤发育较晚时间点出现亚克隆扩增的患者无病生存期明显缩短。
在19%的肿瘤中检测到亚克隆WGD,10%的肿瘤同时含有多个亚克隆WGD。WGD与较短的无病生存期相关。

· 肺癌转移的进化
转移性疾病是大多数癌症相关死亡的原因。这项研究[2]中对126例发生转移的NSCLC患者样本进行了纵向进化分析,并与144例肺转移样本进行了对比。
分析结果显示,在 25% 的病例中,转移在原发肿瘤的最后一次克隆扫描之前就发生了早期分化,早期分化在初次诊断时吸烟的患者中更为丰富。单区域原发肿瘤取样导致 83% 的晚期分歧病例被错误分类为早期,突出了广泛原发肿瘤取样的重要性。
在 32% 的病例中发现了与胸腔外疾病复发相关的多克隆播散。在不到 20% 的病例中,原发性淋巴结疾病导致转移性复发,这是转移潜能的标志,而不是随后复发/疾病进展的途径。转移播种亚克隆在原发肿瘤内表现出亚克隆扩增,可能反映了正向选择。
研究结果强调了选择在未经治疗的原发性肿瘤内的转移性克隆进化中的重要性,单克隆与多克隆播种在决定复发部位的区别,目前针对早期分化肿瘤的放射学筛查方法的局限性以及制定靶向转移策略的必要性。

· 原发瘤和转移瘤的基因组与转录组进化
该研究[3]通过全外显子组和RNA测序技术研究了354个NSCLC肿瘤样本的瘤内转录多样性。
对代表原发肿瘤和转移肿瘤的947个区域和96个与肿瘤邻近的正常组织样本的分析结果显示,转录组是肿瘤表型变异的主要原因。研究者还结合多种机器学习方法,利用基因组合转录组变量将转移潜力与原发瘤内突变和增殖增加的进化背景进行联系。这些分析结果强调了基因组合转录组在影像肿瘤异质性、肺癌进化和转移背后的基因机制。

· 内源性逆转录病毒是免疫治疗的新靶点
此前多项研究发现,三级淋巴结构(TLS)与患者对免疫治疗的反应有关。在该研究中[4]分析了来自TRACERx队列和其他队列中患者的肺部驻留B细胞反应,并在肺腺癌免疫原性小鼠中进行了实验。
研究发现,任何小鼠肺腺癌都会引起局部生发中心反应和抗肿瘤抗体,并进一步确定内源性逆转录病毒 (ERV) 包膜糖蛋白是主要的抗肿瘤抗体靶标。研究发现在小鼠模型中有效的免疫治疗需要CXCL13依赖性TLS的形成。
ERV反应性抗体能够发挥抗肿瘤活性,延长荷瘤小鼠生存期,而且人类患者中ERV的表达也能预测免疫治疗预后。

· 通过ctDNA基于微小残留病预测术后复发
在该研究[5]中,研究人员开发了一种循环肿瘤 DNA (ctDNA)方法,用于检测和分析治愈性治疗后持续存在的残留肿瘤细胞。并开发了一种生物信息学工具 (ECLIPSE),用于在低 ctDNA 水平下无创跟踪亚克隆结构。ECLIPSE 确定了患有多克隆转移播散的患者,这与临床结果不佳有关。
研究结果将支持(新)辅助试验的进展,并使用低ctDNA水平液体活检为转移播散过程提供指导。

· 癌症相关恶病质的管理
癌症相关恶病质(CAC)是非小细胞肺癌患者发病及死亡的重要原因,这项研究[6]分析了CAC与生存之间的关系,并挖掘了与CAC发展有关的潜在生物过程。
通过对651名患者使用计算机断层扫描进行的身体成分分析显示,在诊断时骨骼肌或脂肪分布最少的20%患者,肺癌特异性生存期和总生存期明显缩短。这个发现在另外的队列中也得到了验证。
研究者发现,出现CAC的患者具有特定的肿瘤基因组和转录组,包括炎症信号和上皮-间充质转换途径的富集,以及MAGEA6、ADAMTS3等基因的上调。
进一步分析发现,生长分化因子(GDF15)与体重、骨骼肌和脂肪组织减轻之间存在显著关联,或许能够成为CAC管理的靶点。

· 肺腺癌形态学的进化特征
肺腺癌(LUAD)有广泛的组织学形态,但对形态如何反映肿瘤的进化和疾病进展我们还知之甚少。
这项研究[7]匹配了原发瘤、配对转移样本产生的全外显子组和DNA测序及组织病理学分析,发现高级别肿瘤表现出较高的增殖和较低的克隆多样性。不同组织学特征的肿瘤可见不同的基因频率,表明存在不同的进化轨迹。研究还发现不同形态与复发位置存在关联。

研究团队总结说,理解肿瘤的基因组演化,能对确定肿瘤如何及何时复发的因素提供见解,从而改进人们对肿瘤生物学的理解,或可在未来改善癌症患者结局。
随着这些发现的公布,TRACERx的第一阶段目标基本完成,接下来,研究者们即将开展名为TRACERx EVO的下一阶段计划,将在TRACERx发现的基础上继续深入挖掘肺癌背后的故事,为临床诊疗带来新变革。
参考资料:
[1]Frankell, A.M., Dietzen, M., Al Bakir, M. et al. The evolution of lung cancer and impact of subclonal selection in TRACERx. Nature (2023). https://doi.org/10.1038/s41586-023-05783-5
[2]Al Bakir, M., Huebner, A., Martínez-Ruiz, C. et al. The evolution of non-small cell lung cancer metastases in TRACERx. Nature (2023). https://doi.org/10.1038/s41586-023-05729-x
[3]Martínez-Ruiz, C., Black, J.R.M., Puttick, C. et al. Genomic–transcriptomic evolution in lung cancer and metastasis. Nature (2023). https://doi.org/10.1038/s41586-023-05706-4
[4]Ng, K.W., Boumelha, J., Enfield, K.S.S. et al. Antibodies against endogenous retroviruses promote lung cancer immunotherapy. Nature (2023). https://doi.org/10.1038/s41586-023-05771-9
[5]Abbosh C, Frankell A, Garnett A, et al. Phylogenetic tracking and minimal residual disease detection using ctDNA in early-stage NSCLC: A lung TRACERx study. AACR Virtual Meeting; April 27-28, 2020. Abstract CT023.
[6]Al-Sawaf, O., Weiss, J., Skrzypski, M. et al. Body composition and lung cancer-associated cachexia in TRACERx. Nat Med (2023). https://doi.org/10.1038/s41591-023-02232-8
[7]Karasaki, T., Moore, D.A., Veeriah, S. et al. Evolutionary characterization of lung adenocarcinoma morphology in TRACERx. Nat Med (2023). https://doi.org/10.1038/s41591-023-02230-w































