多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
铁死亡是2012年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。同时,细胞中也有多个对抗铁死亡的防御途径,其中最主要的一个是由谷胱甘肽过氧化物酶4(GPX4)所介导的,通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生。
近年来的一些研究表明,诱导癌细胞发生铁死亡,正在成为一种有前景的癌症治疗新方向。
2023年11月1日,德克萨斯大学西南医学中心唐道林、康睿团队(李静泊、柳娇为第一作者)在 Science 子刊 Science Translational Medicine 上发表了题为:Tumor-specific GPX4 degradation enhances ferroptosisinitiated antitumor immune response in mouse models of pancreatic cancer 的研究论文。
该研究鉴定出了一种小分子化合物——N6F11,它可以选择性地触发肿瘤细胞中的铁死亡抑制剂谷胱甘肽过氧化物酶4(GPX4)的降解,而非免疫细胞中的GPX4,从而选择性诱导肿瘤细胞发生铁死亡,并进一步启动由CD8+T细胞介导的HMGB1依赖性抗肿瘤免疫。
在胰腺癌小鼠模型中试验显示,N6F11治疗增加了肿瘤细胞对免疫检查点阻断(ICB)疗法的敏感性。这些临床前研究结果表明,使用N6F11选择性诱导肿瘤细胞铁死亡,有望成为一种提高癌症患者的免疫检查点阻断疗法效果的新方法。

近年来,免疫疗法的出现改变了癌症治疗格局,显著延长了部分癌症患者的生存期。具体而言,以PD-1、PD-L1为代表的免疫检查点的抑制剂,已被批准作为单药或联合疗法的一部分,通过刺激抗肿瘤CD8+ T细胞反应,发挥癌症治疗效果。
尽管取得了实质性进展,但由于免疫抑制性肿瘤微环境的发展、抗原性肿瘤异质性、免疫原性不足或全身免疫失败,大多数癌症患者对免疫检查点抑制剂反应不佳。因此,需要采取措施来改善大多数癌症患者对免疫治疗的反应。
有效的抗肿瘤适应性免疫应答需要树突状细胞(DC)向T淋巴细胞呈递肿瘤相关抗原。
树突状细胞启动抗肿瘤应答在很大程度上取决于足够的免疫信号,特别是病原相关分子模式和损伤相关分子模式(DAMP)。通过化疗、放疗或靶向治疗诱导免疫原性细胞死亡(ICD),可以通过暴露和释放多种DAMP启动适应性免疫应答,从而诱导对后续免疫检查点治疗的敏感性。然而,目前尚不清楚哪种类型的细胞死亡最能增强肿瘤细胞的免疫原性。
脂质过氧化物依赖的铁死亡已成为一种新兴的肿瘤治疗策略。然而,目前的策略不仅会诱导恶性细胞的铁死亡,同时也会触发免疫细胞的铁死亡,这可能会损害抗肿瘤免疫。
在这项最新研究中,研究团队使用了 In-Cell Western(ICW)结合无偏倚药物筛选,鉴定了化合物N6F11为铁死亡诱导剂,可特异性地在癌细胞中诱发谷胱甘肽过氧化物酶4(GPX4)的降解,而GPX4是铁死亡的关键抑制剂。
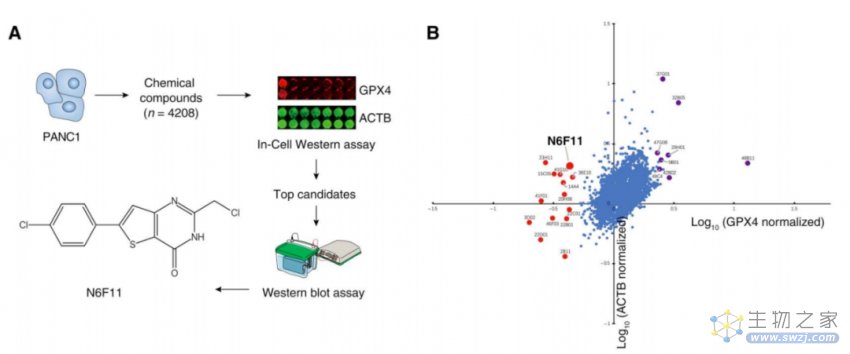
更重要的是,N6F11不会引起免疫细胞(包括树突状细胞、T细胞、NK细胞和中性粒细)中GPX4的降解,因此不会诱导这些免疫细胞的铁死亡。
从机制上讲,N6F11结合到癌细胞中E3泛素连接酶TRIM25的RING结构域,触发TRIM25介导的GPX4的K48-连接泛素化,导致其蛋白酶体降解。从功能上讲,N6F11会诱导癌细胞的铁死亡,启动由CD8+T细胞介导的HMGB1依赖性抗肿瘤免疫。
在晚期癌症模型中,包括由KRAS和TP53突变驱动的基因工程胰腺癌小鼠模型,N6F11治疗增强了靶向PD-L1的免疫检查点阻断疗法的治疗效果。
这些发现有望建立一种安全有效的策略,以促进铁死亡驱动的抗肿瘤免疫。
德克萨斯大学西南医学中心唐道林、康睿为论文共同通讯作者,中南大学湘雅三医院李静泊和广州医科大学附属第三医院柳娇为论文共同第一作者。
论文链接:
https://www.science.org/doi/10.1126/scitranslmed.adg3049































