
阿尔茨海默病(Alzheimer's disease,AD),俗称“老年痴呆症”,是一类主要发生于老年人且以进行性认知功能障碍、行为损害为特征的中枢神经系统退行性病变。目前,全球约有5000万人罹患阿尔茨海默病。随着人类平均寿命增长,老年化社会加剧,阿尔茨海默病的患病率也在不断上升,预计到2050年,阿尔茨海默病患者将增加至1.5亿以上。
阿尔茨海默病等神经退行性疾病的潜在致病原因之一是tau蛋白的神经原纤维缠结(NFT),它会导致神经元死亡,从而导致阿尔茨海默病的症状,例如记忆丧失。除了阿尔茨海默病以外,tau蛋白的神经元纤维缠结还与20多种其他痴呆症和运动障碍有关,例如进行性核上性麻痹、皮克病、慢性创伤性脑病等,这些疾病也被统称为tau蛋白病。
然而,在这些疾病中,tau蛋白如何以及为什么聚集在一起并形成构成NFT的纤维聚集体,目前仍不清楚。这一认知差距给研究人员开发有效的治疗方法带来了巨大挑战。
2023年7月28日,宾夕法尼亚大学佩雷尔曼医学院杨小鲁教授团队等在 Science 期刊发表了题为:TRIM11 protects against tauopathies and is down-regulated in Alzheimer’s disease 的研究论文。
该研究发现TRIM11在人类阿尔茨海默病患者大脑中显著下调,其通过有效抑制tau蛋白的聚集在预防阿尔茨海默病等tau蛋白病中发挥着重要作用。通过腺相关病毒(AAV)载体向小鼠大脑内递送TRIM11,能够显著改善多种tau蛋白病小鼠模型的病理,同时提高认知和运动能力。
此外,TRIM11的表达似乎是高度可控的,通过小分子上调其表达可能是可行的。此外,该研究还提供了一个概念证明——将TRIM11基因本身作为治疗剂,增强细胞的蛋白质质控系统,从根本上解决各种神经退行性tau蛋白病的根本原因。

论文通讯作者、宾夕法尼亚大学杨小鲁教授表示,大多数生物体都有自己的蛋白质质控系统,可以去除有缺陷的蛋白质,防止错误折叠和缠结的积累。但直到现在,我们还不知道这一系统在人类中是如何发挥作用的,或者为什么它在一些人身上正常,而在另一些人身上失灵了。这项新研究第一次确定了监督tau蛋白功能的基因,并且提供了一个有希望的靶点,可以基于此开发预防和减缓阿尔茨海默病及其他相关疾病进展的新疗法。

杨小鲁教授
杨小鲁教授和实验室博士后张子洋(论文第一作者)在之前的研究中发现,TRIM蛋白在动物细胞的蛋白质质控中发挥重要作用,在检查了70多种人类TRIM蛋白后,他们发现TRIM11在抑制tau蛋白聚集方面发挥主要作用。
TRIM11具有与tau蛋白质控相关的三个主要功能。首先,它与tau蛋白结合,尤其是导致疾病的tau蛋白变体,并帮助消除它们。其次,它充当tau蛋白的“伴侣”,防止蛋白质错误折叠。最后,TRIM11溶解预先存在的tau聚集体。
接下来,研究团队利用23名阿尔茨海默病患者死亡后的脑组织和来自神经退行性疾病研究中心组织库的14名健康对照者进行验证。结果发现,与健康对照者相比,阿尔茨海默病患者大脑中的TRIM11蛋白水平显著降低。
为了确定TRIM11作为治疗方法的潜力,研究团队使用腺相关病毒(AAV)载体将TRIM11基因递送到多种小鼠模型的大脑中。结果显示,递送了TRIM11基因的tau蛋白病变小鼠,神经原纤维缠结(NFT)的发展和积累显著减少,认知和运动能力也大幅提高。
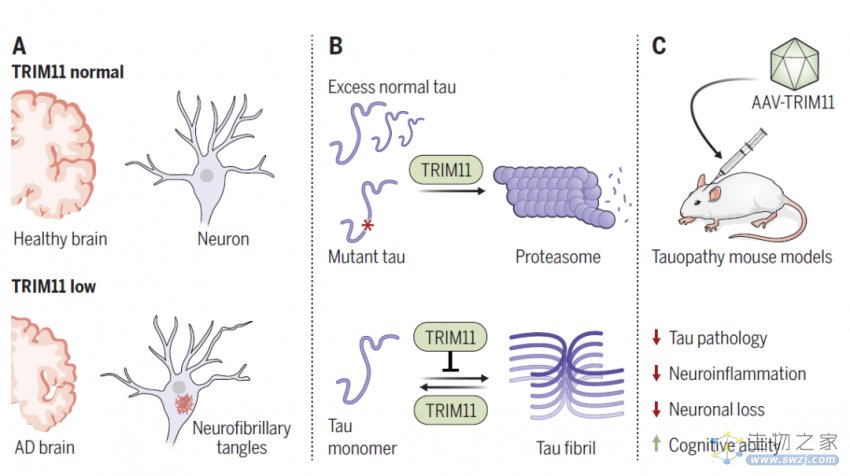
TRIM11在阿尔茨海默病患者大脑中显著下调,恢复其表达具有潜在治疗益处
最后,杨小鲁教授表示,这些发现不仅告诉我们TRIM11可以在保护人们免受阿尔茨海默病和类似疾病方面发挥重要作用,而且还提示我们,提高TRIM11的表达水平可能是有希望的治疗方法。渴望与同事们一起探索开发相关基因疗法的可行性,以阻止神经退行性疾病的进展。
论文链接:https://www.science.org/doi/10.1126/science.add6696































