染色体拷贝数变化,也称为非整倍体,是肿瘤基因组普遍存在的特征。虽然非整倍体在癌症中的普遍存在已有一个多世纪的历史,但非整倍体在肿瘤发展中的作用仍然存在争议。在过去的40年里,癌症研究人员通过使用分子遗传学的标准工具,包括基因的过表达、敲低和突变等手段,来深入了解许多单个癌基因或抑癌基因的作用,例如,KRAS和TP53等基因的生物学功能的阐明就离不开单基因的操作,与此同时,在对单个癌症基因的研究中,科研人员发现了一种被称为“癌基因成瘾”的现象,也即其中单个癌基因的丢失或抑制足以抑制癌症发生或发展。例如,KRAS突变导致胰腺癌的发展,并且在“KRAS成瘾”胰腺肿瘤中使KRAS的表达下降会阻止生长并触发细胞凋亡。
然而,现有的单基因操作方法无法了解同时影响数百个基因后,在染色体尺度上会发生哪些变化。之前我们还不清楚从人类癌细胞中消除特定非整倍体染色体的后果。但是,现有的癌症基因组测序项目已经揭示了在人类肿瘤中观察到的非整倍性模式并不是完全随机和杂乱的,事实上,像染色体1q和8q(1号和8号染色体的长臂)数量增加这样的特定事件比我们预期发生的更加频繁。这种非随机性的非整倍性染色体的出现是否也能代表一种癌症“成瘾”的现象呢?倘若是的话,基于现有的单基因分析技术又如何实现染色体尺度上的遗传学扰动呢?
有人做到了这一点,2023年7月6日,来自耶鲁大学医学院的研究团队在Science上发表了一篇题为Oncogene-like addiction to aneuploidy in human cancers的研究文章,在这项工作中,研究人员采用了一种染色体工程的策略靶向消除了多余的染色体,结果发现这会损伤癌症的发展。这也说明,选择性地靶向额外的染色体可能会为治疗癌症提供一种新途径。
为了测定是哪些特定染色体数量在癌症发展早期增加,研究人员用多样本肿瘤测序数据来确定癌症进化中体细胞拷贝数改变(SCNA)的相对时间,作者重点调查了乳腺癌和黑色素瘤细胞中染色体数的变化,值得注意的是,染色体1q的身影首先浮出水面,其数量的增加是乳腺癌进化中发生的第一次拷贝数改变,这些增加也是黑色素瘤进化中的第一个改变。正如前人在致癌点突变中观察到的那样,特定的染色体增加以一定的时间顺序发生,作者推测在肿瘤发生早期持续获得的非整倍性可能会增强癌症的适应性。除此之外,高水平的非整倍性通常与癌症患者预后不良有关,特定的染色体数增加事件,特别是涉及染色体1q区域,是疾病进展风险的可靠泛癌标志物。
为了进行与非整倍体的可比测定,研究人员创建了一组统称为ReDACT(Restoring Disomy in Aneuploid cells using CRISPR Targeting)的方法,也即使用CRISPR靶向恢复非整倍体细胞,使其重新变为二倍体细胞(图一)。通过这种方法,研究人员成功创建了失去特定非整倍体染色体的人类细胞系。
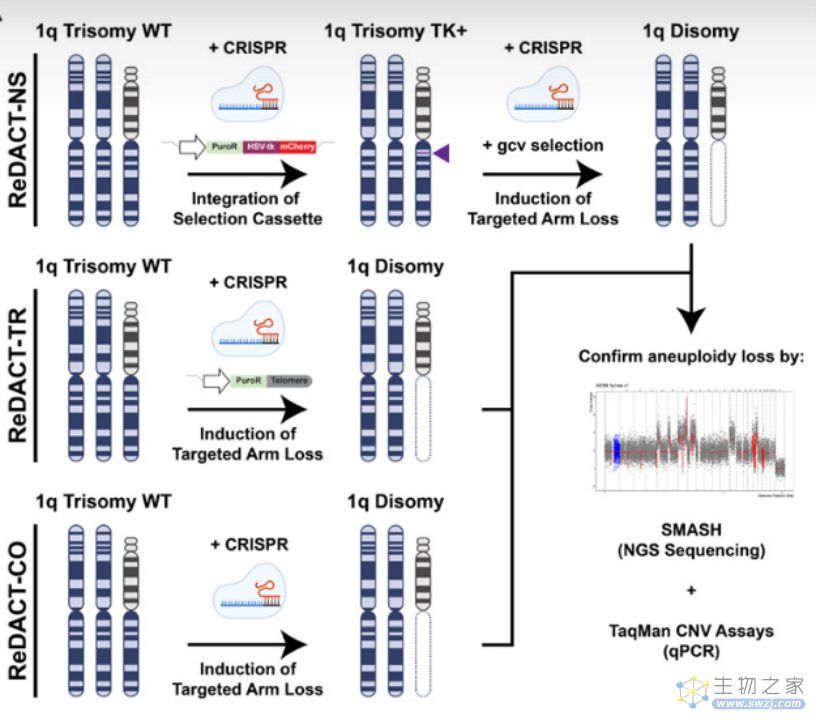
图一:染色体臂靶向缺失的染色体工程策略1
自然,在创建了这样的技术后,作者首先关注的就是染色体1q的非整倍性,在靶向消除非整倍体的黑色素瘤细胞系、胃癌细胞系和卵巢癌细胞系中,1q的缺失使染色体1q上编码的基因在RNA水平上平均降低了26%,在蛋白质水平上降低了21%(图二C),这些结果表明,染色体丢失导致编码在非整倍体染色体上的基因的大量下调,并且,失去了1q的癌细胞恶性生长的速度明显被抑制(图二D)。
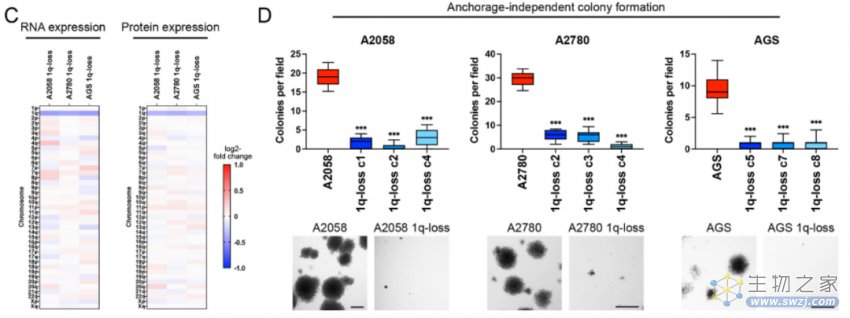
图二:丢失染色体1q-非整倍体的表型效应1
为了进一步研究诱导非整倍体丢失的后果,作者使用ReDACT从A2058黑色素瘤细胞中消除了7p或8q染色体的非整倍性,正如预期的那样,7p或8q的缺失导致受影响染色体上编码的基因表达降低。裸鼠的7p和8q二倍体癌细胞皮下植瘤造模显示,7p或8q非整倍体的丧失导致肿瘤生长的适度降低(图3D)。在测定结束时,野生型肿瘤平均比7p或8q二倍体细胞形成的肿瘤大两倍,而A2058野生型和1q二体肿瘤之间的差异为30倍(图3E)。总的来说,这些结果表明,与7p或8q染色体的多倍体性相比,黑色素瘤细胞对1q多倍体性表现出更大程度的“成瘾”,染色体1q的重要性自然不言而喻。
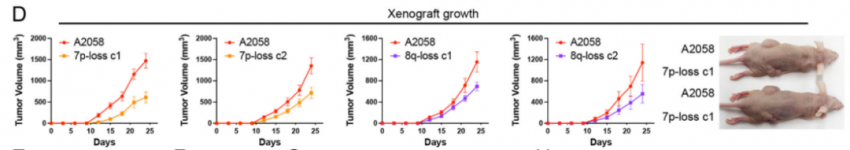
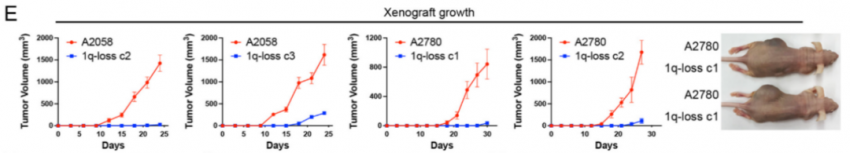
图三:裸鼠皮下植瘤造模对比1
另外,作者还初步揭示了染色体1q非整倍性成瘾的生物学机制。RNA-seq以及蛋白免疫印记等分析手段表明,染色体1q多倍体抑制p53信号传导,消除这种多倍体至少部分可以通过触发p53激活来拮抗恶性生长。同时,位于染色体1q上的MDM4可以抑制p53的信号传导。
在了解了非整倍性成瘾这一现象以后,研究人员并没有止步于此,基于癌基因成瘾假说是在癌症中使用靶向治疗的概念基础,作者团队也在考虑非整倍体是否也可能代表某些癌症的弱点?果不其然,选择性作用于多倍体细胞的化合物可以用来阻止恶性的非整倍体细胞的生长,这或许就提出了这些“非整倍体成瘾性”有望被靶向作用帮助开发新型癌症治疗性策略。
参考文献:
1. Vishruth Girish et al. ,Oncogene-like addiction to aneuploidy in human cancers.Science0,eadg4521DOI:10.1126/science.adg4521































