
衰老通常是指有机体从成年期开始功能衰退的过程,自2013年 Cell 发表第一版“衰老的标志”以来,到目前已发表了近30万篇有关这一主题的文章,这与上一个世纪的总数量相当。
早在2013年,科学家就已提出了衰老的九个分子细胞和系统标志,分别为:DNA不稳定、端粒损耗、表观遗传改变、蛋白质稳态丧失、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭和细胞间通讯改变。
2023年1月,来自西班牙奥维耶多大学肿瘤研究所和法国巴黎大学的科学家在Cell 杂志发表题为:Hallmarks of aging: An expanding universe 的综述论文,该综述在之前的基础上首次创造性的提出了衰老的十二个标志,对理解衰老的发生、发展以及如何干预衰老过程意义巨大。

值得一提的是,就在同一天,本文作者在 Cell Metabolism 杂志发表了题为:Meta-hallmarks of aging and cancer 的综述论文,全面总结了衰老和癌症的特征之间的趋同、对抗或矛盾的关系(点击阅读)。
衰老的特征首先需要满足以下三个要求:
1) 它们应为与年龄相关的表现;
2) 有实验证明诱导它们可以加速衰老;
3) 通过干预它们可以减缓、停止甚至逆转衰老。
基于以上要求,本文提出以下十二个衰老标志:基因组不稳定、端粒损耗、表观遗传改变、蛋白质稳态丧失、大自噬失能、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变、慢性炎症和生态失调。
这十二个衰老标志除了对之前的标志进行必要的更新外,还进行了一些重组,包括以下三个额外的衰老标志:大自噬失能、慢性炎症和生态失调。这些特征相互之间关系密切,并且与最近提出的健康特征相互关联,包括空间分隔的组织特征、体内平衡的维持和对压力的反应。

图1 衰老的标志
“标志”之间的区别本质上是分散的,但它们之间却又相互依赖,相互依赖意味着一个特定标志会影响其他标志。这强调了一个事实,即衰老是一个必须作为整体来考虑的复杂过程。因此,每个特征都应被视为未来探索衰老过程以及开发新的抗衰老药物的切入点,下面我们将一一进行阐述。
基因组不稳定
基因组的完整性和稳定性普遍受到外源性和内源性因素威胁,外源性因素包括化学因素、物理因素和生物因素等,内源性因素包括DNA复制错误、染色体分离缺陷、氧化以及自发水解等。由这些外在或内在损伤来源引起的广泛遗传病变包括点突变、缺失、易位、端粒缩短、单链和双链断裂、染色体重排、核结构缺陷以及病毒或转座子整合引起的基因破坏。
所有这些分子的改变和由此产生的基因组嵌合都有可能导致衰老的发生。因此,生物体已经进化出一系列复杂的DNA修复和维持机制,以处理这些因素对核DNA和线粒体DNA(mtDNA)造成的损伤,并确保适当的染色体结构和稳定性。这些DNA修复网络随着年龄的增长而逐渐丧失功能,这也加剧了基因组损伤的积累和细胞质中DNA的异位积累。
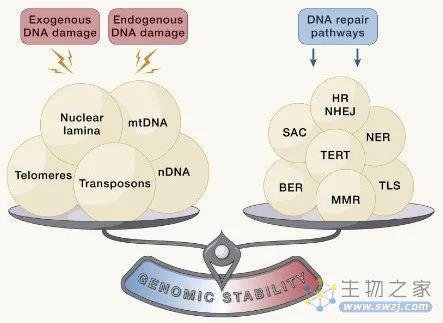
图2:基因组不稳定
端粒损耗
众所周知,染色体末端(端粒)的 DNA 损伤会导致衰老和与年龄相关的疾病的发生,复制型 DNA 聚合酶无法完成真核 DNA 端粒区域的复制。因此,经过几轮细胞分裂后,端粒会大幅缩短,从而导致基因组不稳定,最终导致细胞凋亡或细胞衰老。
这些有害作用可以通过端粒酶的逆转录酶活性来预防,端粒酶是一种活性核糖核蛋白,可以延长端粒以保持其维持足够的长度。然而,大多数哺乳动物体细胞不表达端粒酶,这导致端粒序列在整个生命过程中在染色体末端逐渐被侵蚀。以往研究表明,端粒损耗可以通过限制恶性细胞的复制来减弱致癌作用。因此,与明确有利于肿瘤发生的基因组不稳定性相反,端粒损耗可能可以对抗恶性肿瘤。
人类端粒酶缺乏与肺纤维化、再生障碍性贫血和先天性角化不良等疾病的过早发展有关,所有这些都会阻碍受影响组织的再生能力。在许多不同物种(包括人类和小鼠)的正常衰老过程中也观察到端粒缩短。端粒损耗率受年龄、遗传变异、生活方式和社会因素的影响。端粒缩短也可能由 shelterins 的缺陷引起,shelterins 是一组蛋白质,可阻断染色体末端的 DNA 损伤反应并调节端粒长度。
在人类中,许多研究提供了短端粒长度与年龄相关疾病之间因果关系的证据,利用端粒动力学与机体衰老之间的这些联系可以用来干预衰老和与年龄相关的疾病,例如,使用基因治疗策略激活端粒酶已显示出对肺纤维化和再生障碍性贫血小鼠模型的治疗效果。
表观遗传改变
导致衰老的各种表观遗传变化包括 DNA 甲基化模式的改变、组蛋白的异常翻译后修饰、异常的染色质重塑和非编码RNA(ncRNA)的失调功能。
这些调节性通常会影响基因表达和其他细胞过程,从而导致多种与年龄相关的人类病理学的发展和进展,例如癌症、神经变性、代谢综合征和骨病。
大量的酶系统参与表观遗传模式的产生和维持。这些酶包括 DNA 甲基转移酶、组蛋白乙酰化酶、去乙酰化酶、甲基化酶和去甲基化酶,以及与染色质重塑或 ncRNA 合成和成熟有关的蛋白质复合物。
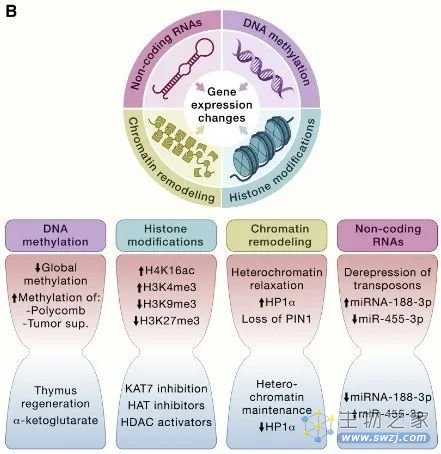
图3 表观遗传改变引起的细胞完整性丧失
蛋白质稳态丧失
由于错误翻译、错误折叠或不完整蛋白质的产生增加,细胞内蛋白质稳态可能被破坏。核糖体蛋白 RPS23 的遗传操作可提高 RNA 到蛋白质翻译的准确性,从而延长了粟酒裂殖酵母、秀丽隐杆线虫和黑腹果蝇的寿命,而 RPS9 中的一种突变则会致小鼠过早衰老。
另一种驱动蛋白质稳态网络崩溃的机制在于减缓蛋白质的翻译延伸和累积氧化损伤,越来越多地分散伴侣蛋白折叠细胞健康所需的健康蛋白质。此外,许多与年龄相关的神经退行性疾病,包括肌萎缩侧索硬化和阿尔茨海默氏症,可能是由蛋白质突变引起的,这些突变使它们本质上容易发生错误折叠和聚集。
当确保质量控制的机制失败时,蛋白质稳态网络也会崩溃,例如,由于内质网中未折叠蛋白质反应(UPR)的功能降低,当正确折叠蛋白质的稳定性受到损害或降解机制时蛋白酶体或溶酶体对蛋白质的处理变得不足。此外,一些单泛素化蛋白在苍蝇、小鼠、猴子和人类的衰老组织中积累,如组蛋白所记录的那样。
溶酶体对蛋白质的降解可以通过伴侣介导的自噬(CMA)以特定方式实现,其中暴露出类似于 KFERQ 的五肽基序的蛋白质首先与热休克蛋白 HSC70 结合,然后与溶酶体相关膜蛋白 2A 型结合(LAMP2A),它促进客户蛋白易位到溶酶体腔内。小鼠肝脏 LAMP2A 表达随着年龄的增长而下降,其转基因重新表达可减少肝脏老化。蛋白质聚集体也可以通过巨自噬去除,因为它们包含在双膜囊泡(自噬体)中。尽管如此,自噬的刺激构成了消除细胞内蛋白质聚集体的有效策略。
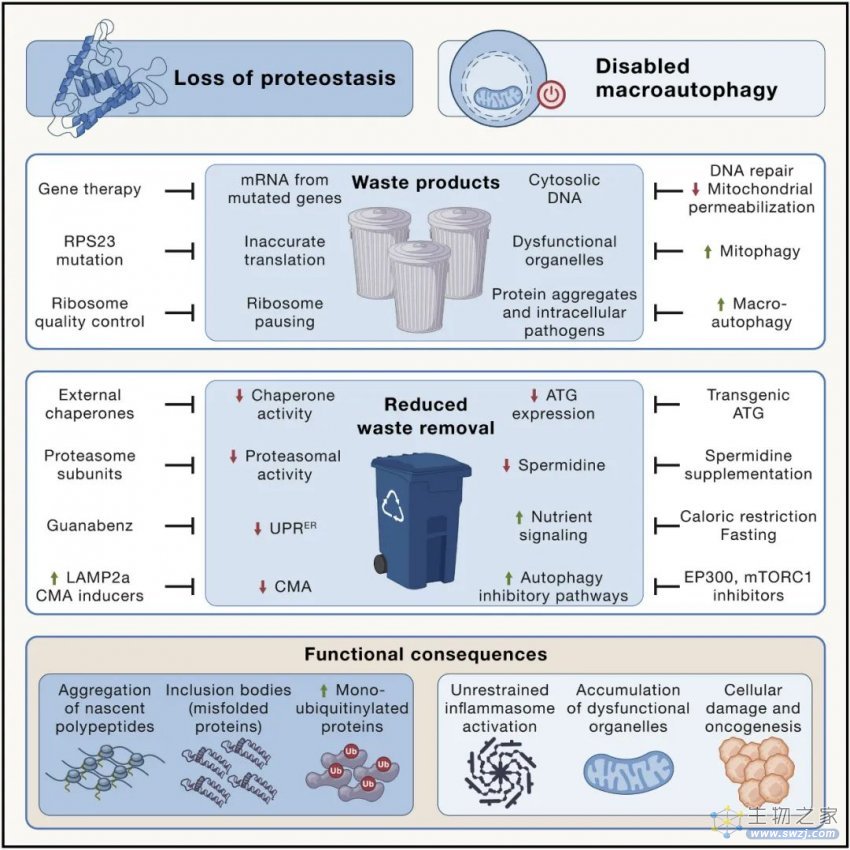
图4 蛋白质稳态丧失
大自噬失能
大自噬(我们将称之为“自噬”)涉及将细胞质隔离在双膜囊泡中,自噬体随后与溶酶体融合以消化管腔内容物。
因此,自噬不仅参与蛋白质稳态,还影响非蛋白质大分子(如异位胞质 DNA、脂质囊泡和糖原)和整个细胞器(包括线粒体自噬靶向的功能失调线粒体,导致“溶食性”的其他细胞器以及网状噬菌体)以及入侵的病原体。
与年龄相关的自噬下降是细胞器更新减少的最重要机制之一,证明将其作为衰老的新标志进行讨论是合理的。需要注意的是,参与自噬过程的基因和蛋白质也参与其他降解过程,例如 LC3 相关的细胞外物质吞噬作用和以外球体形式排出细胞内废物(例如,功能失调的线粒体)随后被巨噬细胞清除。也就是说,有强有力的证据表明自噬的核心过程与衰老相关。
营养感应失调
营养感应网络在进化过程中高度保守,它包括细胞外配体,如胰岛素和胰岛素样生长因子、它们相互作用的受体酪氨酸激酶,以及细胞内信号级联。这些级联涉及 PI3K-AKT 和 Ras-MEK-ERK 通路,以及转录因子,包括 FOXO 和 E26 因子,它们反式激活参与不同细胞过程的基因。
雷帕霉素复合物1(mTORC1)的机制靶标对营养物质(包括葡萄糖和氨基酸)以及压力源(例如缺氧和低能量)作出反应,以调节包括转录因子(例如 SREBP 和 TFEB)在内的多种蛋白质的活性。
该网络是细胞活动的中央调节器,包括自噬、mRNA 和核糖体生物发生、蛋白质合成、葡萄糖、核苷酸和脂质代谢、线粒体生物发生和蛋白酶体活性。
如果营养物质存在且压力较低,网络活动会通过激活合成代谢来响应营养和压力状态,或者通过诱导细胞防御途径来响应压力和营养短缺。在网络内部以及它与其他细胞内信号通路之间存在广泛的细胞内串扰和反馈,营养感应网络成分的基因活性降低可以延长不同动物模型的寿命和健康寿命。
此外,人类遗传关联研究表明 FOXO3 转录因子和编码网络成分的遗传变异与人类长寿有关。表观遗传年龄也与人体细胞的营养感知有关,在青年时期这种信号网络起到促进有益合成代谢过程的作用,但在成年时期,却拥有了促衰老特性。
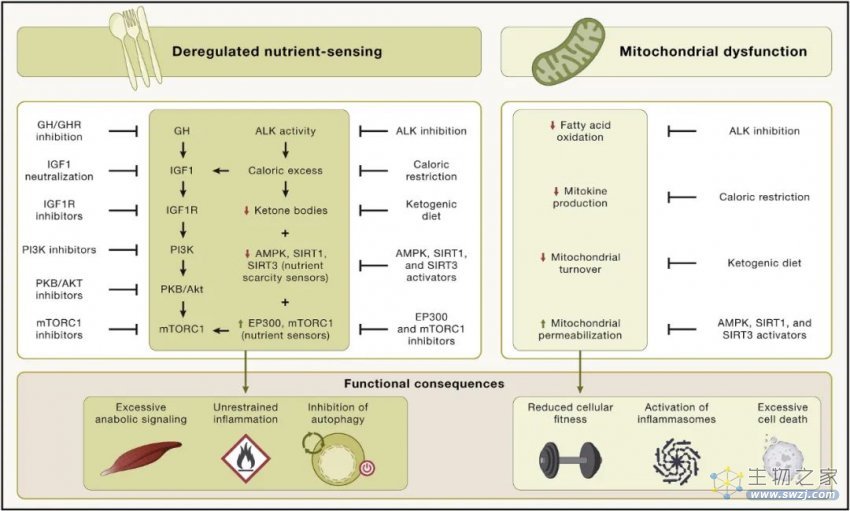
图5 代谢改变
线粒体功能障碍
线粒体不仅是细胞的动力源,而且还构成潜在的炎症触发因素(当活性氧 [ROS] 或 mtDNA 从细胞器中泄漏时,分别导致炎症小体或细胞溶质 DNA 传感器的激活)和细胞死亡(当半胱天冬酶的激活剂、核酸酶或其他致命酶从膜间隙中释放出来)。
随着衰老,线粒体功能因多种相互交织的机制而恶化,包括线粒体 DNA 突变的积累、导致呼吸链复合物不稳定的蛋白质稳态不足、细胞器周转减少以及线粒体动力学变化。
这种情况损害了线粒体对细胞生物能量学的贡献,增强了 ROS 的产生,并可能引发线粒体膜的高度通透性,从而导致炎症和细胞死亡。从逻辑上讲,线粒体的功能对于维持健康至关重要,其进行性退化会导致衰老表型。
细胞衰老
细胞衰老是由急性或慢性损伤引起的反应。在人类中,衰老细胞以不同的速率在多个组织中积累,当比较年轻(<35 岁)和老年(>65 岁)健康供体时,发现衰老细胞速度差异可高达是2-20 倍,主要影响成纤维细胞、内皮细胞和免疫细胞。
所有类型的细胞都会经历衰老,这一过程至少部分是由端粒随衰老缩短而触发的。事实上,即使是有丝分裂后或缓慢增殖的组织,如大脑或心脏,也可能含有衰老细胞。
此外,在许多疾病中都会发生局灶性或组织特异性衰老细胞积聚。细胞衰老中因果作用的最令人信服的证据是,衰老细胞的持续遗传或药理学消除延长了自然衰老小鼠的健康寿命和寿命。衰老细胞的遗传或药理学消除在许多以小鼠为模型的疾病中具有治疗作用,并且至少3项临床试验已经完成,15 项临床试验正在进行或计划针对各种适应症的衰老。
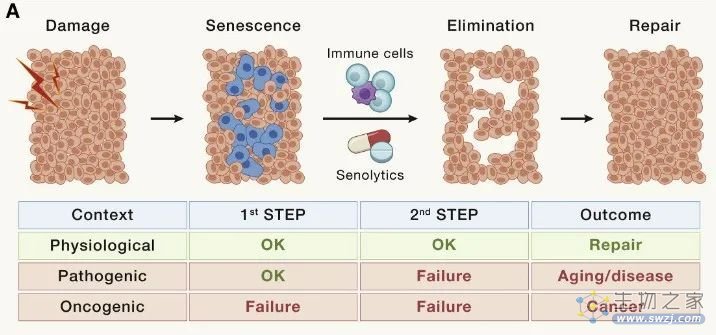
图6 细胞衰老
干细胞耗竭
衰老与稳定状态下组织更新减少以及损伤后组织修复受损有关,每个器官都有自己的更新和修复策略。例如,在骨骼肌中,一种单细胞类型,即卫星细胞,位于单能和单向层次结构的顶端,用于更新和修复。
在以高度更新和易受伤害为特征的皮肤表皮中,存在多个干细胞壁龛,特别是与毛囊相关的干细胞壁龛,每个壁龛都会产生其后代和区域。然而,一旦受伤,多个细胞可以获得干细胞特性并颠覆边界。其他器官,如肝脏、肺或胰腺,在正常情况下表现出相当低的更新率,这与不同细胞类型获得的干细胞特性(包括增殖和多能性)形成鲜明对比。
事实上,组织修复被认为在很大程度上依赖于损伤诱导的细胞去分化和可塑性。例如,在肠、脑和肺中,损伤会诱导非干细胞去分化,从而重新激活通常沉默的胚胎和干性转录程序,从而获得组织修复所需的可塑性。
与常驻干细胞在正常稳态条件下的可塑性相比,损伤诱导的可塑性(及其随着衰老逐渐丧失)可能与衰老更相关。干细胞和祖细胞与没有干细胞潜能的细胞一样都具有相同的衰老特征。因此,在此不讨论关于每个衰老特征对干细胞功能影响的大量文献。相反,将基于“细胞重编程”的概念,专注于应对干细胞功能随衰老而下降的一般策略。这个过程被认为以细胞自主的方式作用于多种细胞类型;然而,由于其长期影响,它对干细胞和祖细胞的影响被认为具有更高的相关性。
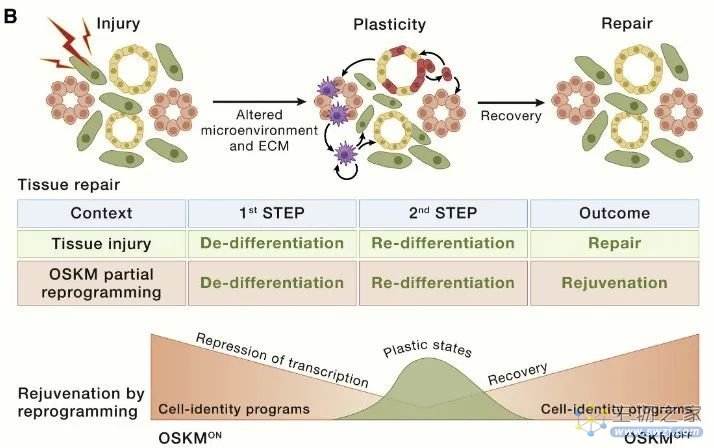
图7 干细胞耗竭
细胞间通讯改变
衰老与细胞间通讯的逐渐改变有关,这会损害稳态和激素调节。因此,衰老涉及神经、神经内分泌和激素信号通路的缺陷,包括肾上腺素能、多巴胺能和基于胰岛素/IGF1 和肾素-血管紧张素系统,以及与生殖功能丧失相称的性激素。
虽然这种改变的主要原因是细胞内在的,因为这在 SASP 中有特别详细的记录,但细胞间通讯的这些紊乱最终归结为一个标志,它将细胞内在标志与元细胞标志联系起来,包括时间化炎症反应的增加,加上对病原体和癌前细胞的免疫监视能力下降,以及人类基因组和微生物组之间双向交流的改变,最终导致生态失调。
这方面的许多研究都集中在寻找具有促衰老或延长寿命特性的血源性系统因素、细胞间不同通信系统的作用,以及对衰老过程中 ECM 破坏的功能相关性的评估。
慢性炎症
炎症在衰老过程中增加,伴有全身表现,以及病理性局部表型,包括动脉硬化、神经炎症、骨关节炎和椎间盘退变。因此,炎症细胞因子和生物标志物的循环浓度会随着年龄的增长而增加。
血浆中升高的 IL-6 水平构成了人口老龄化全因死亡率的预测性生物标志物。随着炎症的加剧,免疫功能下降,这种现象可以通过对患者和小鼠组织血液中的骨髓和淋巴细胞进行高维监测来捕捉。
例如,一群与年龄相关的T细胞(称为Taa细胞)由耗竭的记忆细胞组成,这些细胞通过颗粒酶K介导促炎作用。T细胞群的变化导致促炎性TH1和TH17细胞功能亢进、免疫监视缺陷(对病毒感染、恶性或衰老细胞的消除有负面影响)、自身耐受性丧失(导致自身免疫疾病中年龄相关的增加)以及生物屏障的维持和修复减少,这些都会导致全身性炎症的发生。
尽管全身性炎症在机制上与上述所有与年龄相关的改变有关,但炎症本身就是一个标志。事实上,对炎症和免疫系统的特定操作可以加速或减缓不同器官系统的衰老过程。
例如,线粒体转录因子A(TFAM)中的T细胞特异性缺陷足以驱动心血管、认知、代谢和身体衰老,同时循环细胞因子增加,TNF-α抑制剂依那西普可以部分逆转了这种表型。
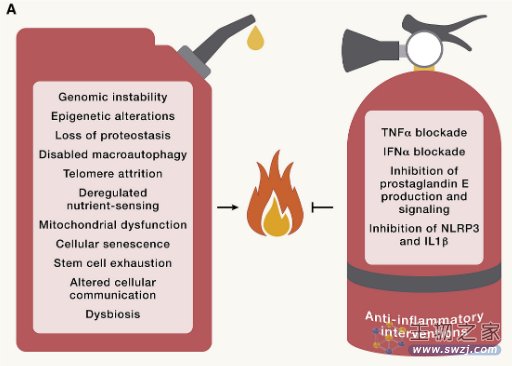
图8 炎症诱导的衰老
生态失调
近年来,肠道微生物组已成为多种生理过程的关键因素,例如营养消化和吸收、抵御病原体以及产生必需代谢物(包括维生素、氨基酸衍生物、次级胆汁酸和短链脂肪酸) 。
肠道微生物群还会向外周和中枢神经系统以及其他远处器官发出信号,并对宿主健康的整体维持产生至关重要的作用。这种细菌-宿主双向通讯的中断会导致生态失调,并导致各种病理状况,例如肥胖、2 型糖尿病、溃疡性结肠炎、神经系统疾病、心血管疾病和癌症。这一领域的进展引起了人们对探索衰老过程中肠道微生物群变化的极大兴趣。
对百岁老人肠道微生物组的进一步代谢组学和功能分析表明,Alistipes putredinis和Odoribacter splanchnicus在某些特定细菌中富集。其中一些细菌种类能够产生独特的次级胆汁酸,包括异异石胆酸,它对革兰氏阳性多药耐药病原体(如艰难梭菌和粪肠球菌)具有强大的抗菌作用。因此,特定的胆汁酸代谢可能参与降低致病菌感染的风险并有助于肠道稳态,从而降低对与年龄相关的慢性疾病的易感性。
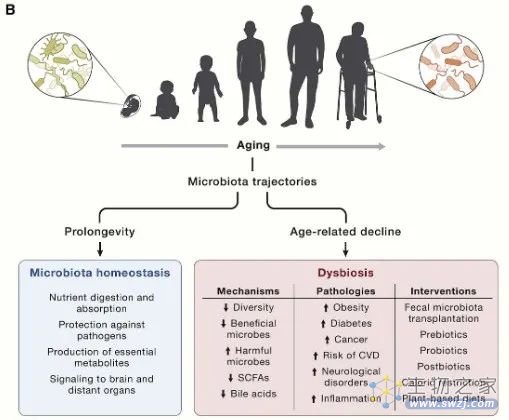
图9 肠道微生物和衰老息息相关
总而言之,衰老的所有 12 个标志彼此之间密切相关。例如,基因组不稳定性与表观遗传改变相互影响串扰,大多数衰老标志都可以列出类似的功能关系,说明它们强大的相互关联性。
最后,作者假设存在八个健康标志,其中包括空间划分的组织特征(屏障的完整性和局部扰动的遏制),随着时间的推移维持体内平衡(循环和周转,电路整合和节奏振荡)。
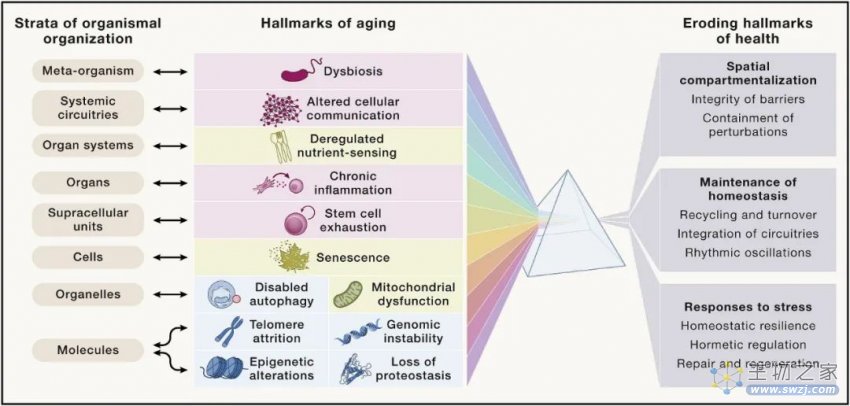
图10 八个健康标志与衰老的关系
毫无疑问,衰老与这八个健康标志的逐渐恶化有关,这意味着维持空间划分能力随着衰老在不断下降。这种下降影响了有机体组织的所有八个层次,涉及不同类别的分子、细胞器以及细胞类型。因此,衰老的12个标志与健康状况不佳的八个标志和有机组织的八个层次相互关联,创建一个多维交互空间,用以解释衰老过程的众多特征。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(22)01377-0































