脊髓作为中枢神经系统的重要组成部分,是连接大脑和周围神经的重要桥梁,支配着全身各种运动功能。而这些运动调节功能的主要执行者则是脊髓内一群稀少(仅占脊髓全部细胞约0.3-0.4%)而又关键的细胞——运动神经元(motor neuron)。运动神经元最重要的功能是通过支配全身的骨骼肌实现对机体运动行为的控制。
据统计,老年人在60岁以后会发生运动能力的快速下降,65岁以上的老年人平均每年都会因行动不便等原因发生一次以上跌倒事件,20-30%的老年人经历过中度甚至重度摔伤,严重影响了活动能力和生活质量。除了调节肢体运动,运动神经元还能通过植物神经系统协同控制机体的呼吸、心跳、摄食和排泄等一系列基本生命活动(图1)。由此可见,脊髓是人体运动及基本脏器自主活动的“指挥部”。脊髓的老化可能导致多器官系统功能障碍,引发行动不便、心律失常、血压失调、胸闷气短等问题,是老年人多种慢病共存的重要诱因之一。

图1. 脊髓衰老与多种器官的退变密切相关(研究团队供图)
尽管脊髓对于人体的各种生命活动至关重要,但我们对于脊髓衰老的机制仍知之甚少。哪些生物标志物能够指征脊髓衰老?脊髓衰老的驱动力是什么?能否开发出干预脊髓衰老的手段?一系列关键科学问题亟待解答。
2023年10月31日,中国科学院动物研究所刘光慧课题组联合中国科学院北京基因组研究所张维绮课题组、中国科学院动物研究所曲静课题组合作,在国际顶尖学术期刊 Nature 上发表了题为:CHIT1-positive microglia drive motor neuron aging in the primate spinal cord 的研究论文。
该研究历时7年,通过综合运用单细胞核转录组、神经组织学、神经电生理等技术手段,发现了一群全新的在年老的灵长类动物的脊髓中特异存在的CHIT1阳性小胶质细胞亚型,并将其命名为——AIMoN-CPM(Aging-Induced Motor Neuron toxic CHIT1-Positive Microglia),这类细胞可以通过旁分泌CHIT1蛋白激活运动神经元中的SMAD信号,进而驱动运动神经元衰老,而补充维生素C可抑制脊髓运动神经元的衰老和退行。

非人灵长类食蟹猴同人类的神经系统极为相似,尤其在两足行走和精细运动控制方面。因此,以食蟹猴作为研究模型,在理解人类自身的神经系统功能及干预神经退行性疾病方面具有特殊的优势。
研究团队首先通过人工智能(AI)辅助的方式,发现年老猴的运动能力与年轻个体相比显著降低。进而借助神经组织学分析手段,研究团队证实运动神经元是脊髓中对衰老最为敏感的细胞类型,具体表现为细胞衰老相关标志物显著增加以及神经元功能的退行。
为进一步揭示运动神经元老化的原因,研究团队绘制了一张详细的食蟹猴衰老脊髓单细胞转录组导航图。按图索骥,寻找到了驱动运动神经元衰老的罪魁祸首,即一群在老年灵长类脊髓中特异性积累的CHIT1高表达的激活型小胶质细胞(AIMoN-CPM)。通过组织病理学、细胞生物学和分子生物学分析,研究团队发现AIMoN-CPM倾向于聚集在衰老的运动神经元周围,并通过旁分泌CHIT1蛋白激活周边运动神经元中的SMAD信号,进而驱动后者的衰老和退行(图2)。

图2:衰老灵长类脊髓中AIMoN-CPM小胶质细胞(红色)在运动神经元轴突(绿色)处聚集
进一步研究发现,CHIT1含量在老年人和猴的脑脊液和血清中均显著升高,提示CHIT1可以作为度量灵长类脊髓年龄的体液标志物。而利用手术机器人将CHIT1注射到猴的脑脊液中可以触发脊髓运动神经元衰老及轴突传导功能障碍,进而损伤机体运动能力。接下来,研究团队建立了人类运动神经元与微环境的体外互作模型,并利用该模型揭示老年个体的脑脊液能以CHIT1依赖的方式诱导人类运动神经元衰老。靶向CHIT1的中和抗体可以有效阻断老年脑脊液的促神经元衰老活性,显示出CHIT1作为靶点应用于延缓运动神经元衰老的潜力。
更为重要的是,研究团队基于人类运动神经元与微环境的体外互作模型进行药物筛选时,发现维生素C能有效抑制CHIT1诱导的运动神经元衰老。进一步,非人灵长类体内实验表明,三年维生素C的口服用药可以明显改善老年食蟹猴脊髓运动神经元的衰老表型(图3)。
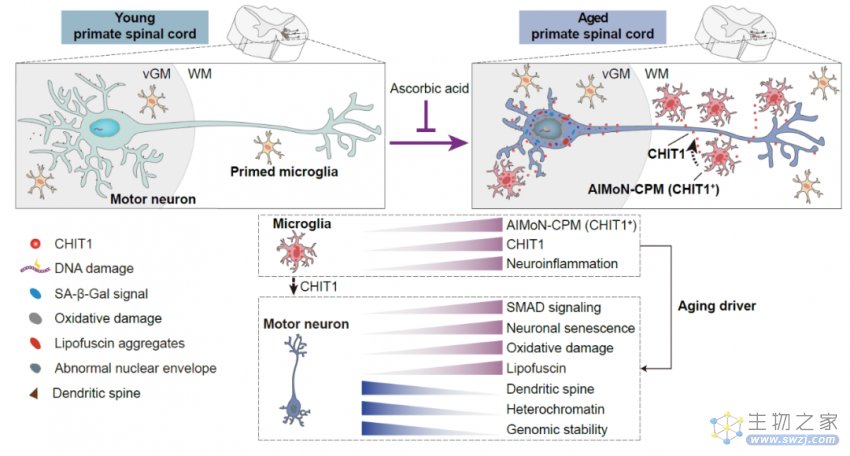
图3. 灵长类脊髓衰老全景图
综上,该研究首次系统刻画了灵长类脊髓衰老的表型、病理及细胞分子特征,并揭示了一种可促进运动神经元衰老的新型小胶质细胞AIMoN-CPM。CHIT1不仅介导了AIMoN-CPM对运动神经元的毒性作用,而且可以作为一种度量人类脊髓衰老程度的体液标志物。更为重要的是,该研究创新性地建立了人类运动神经元-微环境互作研究体系,为开展人类神经系统衰老研究及相关的药物评价提供了新范式。鉴于脊髓运动神经元对于遍布全身的包括骨骼肌、平滑肌和心肌在内的肌肉系统的指挥调控作用,加深对灵长类脊髓衰老机制的认识无疑会深化学术界对人类多种器官退变规律的理解。AIMoN-CPM和CHIT1的发现,为理解脊髓衰老及老年群体多种慢病共存开辟了新的科学疆域,以AIMoN-CPM和CHIT1为靶标,或可为延缓人类脊髓衰老、实现老年共病的积极防控带来新的希望。
未来围绕着AIMoN-CPM、CHIT1与脊髓衰老,将会涌现出更多的科学问题,例如:
是否可以通过定量检测脑脊液和血清中的CHIT1含量来评价人类的“脊髓年龄”?
其含量在增龄过程中是否存在关键的拐点?
CHIT1在人类基因组中编码序列是否具有遗传多态性?
这种多态性是否是个体间脊髓健康和衰老差异的原因?
CHIT1是否可以通过体液作用于其他器官或细胞类型,并触发其衰老?
AIMoN-CPM和CHIT1能否成为肌萎缩性脊髓侧索硬化症(ALS)等脊髓退行性疾病的驱动力和生物标志?
它们在灵长类脊髓损伤修复过程中是否也发挥作用?
靶向CHIT1的中和抗体、siRNA或反义寡核苷酸(ASO)能否成为延缓脊髓衰老或治疗脊髓退行性疾病的策略?
由于脊髓作为“指挥部”控制着机体重要器官的自主运动功能,对脊髓衰老的干预可否实现多种慢病的防治?
除了维生素C,是否还有其他小分子药物可以延缓灵长类脊髓衰老?
期待随着科学和技术手段的不断革新,这些谜题将得以逐一解开。
中国科学院动物研究所刘光慧研究员、中国科学院北京基因组研究所张维绮研究员和中国科学院动物研究所曲静研究员为文章的共同通讯作者。中国科学院动物研究所、北京干细胞与再生医学研究院孙淑慧“致一”研究员、中国科学院北京基因组研究所博士研究生李嘉明、首都医科大学宣武医院王思研究员、中国科学院动物研究所、北京干细胞与再生医学研究院李静宜“致一”研究员、中国科学院北京基因组研究所任捷研究员、首都医科大学孙乐研究员、首都医科大学天坛医院保肇实副教授、中国科学院自动化研究所马喜波研究员为论文的并列第一作者。该研究得到首都医科大学天坛医院江涛教授、首都医科大学宣武医院赵国光教授、北京师范大学王晓群教授、北京医院黎健教授、第三军医大学王延江教授、浙江大学白戈研究员、中国科学院动物研究所刘长梅研究员和滕兆乾研究员的指导及支持。
文章链接:
https://www.nature.com/articles/s41586-023-06783-1































