随着第三代基因编辑技术——CRISPR/Cas9技术斩获2020年诺贝尔化学奖,“基因编辑”一词便频繁地出现在大众视野中。然而,这把基因的“手术刀”只有被送到靶细胞才能发挥其特定作用,因此,在体内精准递送基因编辑系统仍然是该技术应用于医药学领域的重大挑战之一。
基因编辑是指特异性改变基因序列,利用酶来对DNA链进行剪切,移除已有的DNA片段,或者插入代替的DNA片段的技术。在过去的20多年里,以核酸酶为基础的基因编辑工具的出现,带来了基因编辑技术的蓬勃发展。与传统的基因编辑技术相比,基于核酸酶的基因编辑技术减少了外源基因的随机插入,提高了对基因组特定片段进行精确修饰的概率。
基因编辑工具
基于DNA核酸酶的基因编辑技术发展迅速,从第一代锌指核酸酶(zinc-finger nuclease, ZFN)基因编辑系统、第二代转录激活因子样效应物核酸酶[transcription activator-like (TAL) effector nuclease, TALEN]基因编辑系统,到第三代CRISPR/Cas9系统,基因编辑效率不断提高,成本不断降低,应用范围不断扩大。
1996年,相关研究团队将两种不同的锌指蛋白(zinc finger protein, ZFP)(负责识别DNA位点)和FokⅠ内切酶的切割区域(负责切割DNA)连接在一起,构建了ZFN基因编辑系统。该技术使人工定点诱导双链DNA断裂成为现实,实现了基因编辑技术里程碑式的突破;2001年开始陆续用于不同物种的基因编辑,不仅可构建基因编辑模式生物,还可用于遗传育种和基因治疗。
然而,ZFN系统存在精准性欠佳和细胞毒性等问题,随后出现的TALEN基因编辑系统在一定程度上改善了上述问题。和ZFN系统类似,TALEN系统由识别特异DNA序列的转录激活效应蛋白(TALEs)及Fok I内切酶组成。该技术设计简单,大大提高编程性能,自2011年建立后迅速用于构建基因修饰动物模型、遗传育种和基因治疗等领域。
第三代基因编辑技术的出现很快掩盖了ZFN和TALEN的光芒。CRISPR/Cas9系统由核酸酶Cas9和特异性识别基因组序列的向导RNA(guiding RNA, gRNA)组成。发挥DNA剪切功能的Cas9元件是通用的,因此只需要根据靶基因的不同设计相应的gRNA即可,其设计难度和复杂度远低于ZFN和TALEN,大大拓展了CRISPR/Cas系统的应用前景[1]。2012年,系列体外实验证明了CRISPR/Cas9系统用于基因编辑的可能性[1],2013年,该系统被应用于哺乳动物细胞中基因组的多位点精准编辑[1],这些发现引发了基因编辑研究和应用的爆炸性增长。
基因编辑递送系统
基因编辑工具只有被递送到靶点部位才能真正发挥作用,其在应用于疾病治疗时主要有两种递送形式:一是从患者体内提取需要改造的细胞,在体外用基因编辑技术进行工程化改造后,再回输至患者体内;二是通过各种形式的制剂实现基因编辑系统在体内的递送,把基因“手术刀”递送至靶组织或靶细胞中进行治疗。
然而,在递送过程中存在诸多挑战。首先,为了防止不良反应的产生,需要把基因编辑工具准确递送体到内的特定部位。笔者团队曾在2021年开发了一种具有炎症靶向性的基因编辑前药系统[3],选用一种受小分子调控的Cas9变体,并将这种小分子设计成只有在炎症环境中才能被激活的前药,从而减少了基因编辑治疗过程中的组织脱靶问题。其次,基因编辑工具通过细胞膜进入细胞并非易事。对于CRISPR/Cas系统而言,递送主要分为gRNA的递送和Cas蛋白的递送。其中,gRNA可以直接以RNA形式递送,或通过质粒DNA形式递送到体内后再完成转录;而Cas蛋白有3种递送形式:递送对应的质粒DNA、mRNA或直接递送蛋白。这些生物大分子由于尺寸问题和特殊的荷电性质,往往需要特定的载体或物理方法来介导进入细胞[4],如使用病毒载体和非病毒载体、采用显微注射、电穿孔、基于微流控的技术等物理方法等[5]。
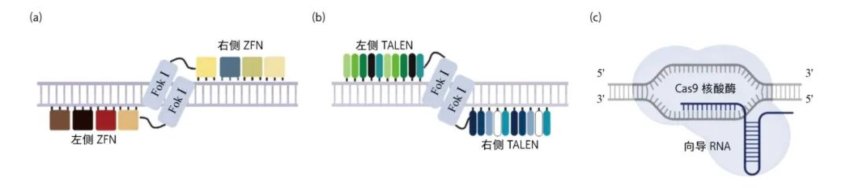
3代基因编辑工具 (a)ZFN基因编辑技术;(b)TALEN基因编辑技术;(c)CRISPR/Cas9基因编辑技术系统。
病毒基因编辑递送系统
病毒系统是相对来说比较成熟的基因编辑递送系统,常用的载体有整合酶缺陷型慢病毒载体、腺相关病毒载体和腺病毒载体。
整合酶缺陷型慢病毒载体
整合酶缺陷型慢病毒载体由慢病毒改造而来,由于整合酶缺陷而无法将目的基因整合入宿主的基因组中,具有一定的安全性。这类系统可被用于递送ZFN基因编辑工具。在体外,整合酶缺陷型慢病毒可通过递送ZFN基因编辑工具的mRNA和供体DNA模板,在各种细胞中实现基因编辑。然而在某些细胞系内,该系统的编辑效率并不高,同时,其基因编辑效果会随着靶点细胞的分裂而逐渐减弱[2]。
腺相关病毒载体
腺相关病毒载体是一种含有单链线状DNA的小型无包膜病毒,其基因组中包含两个反向末端重复序列,通常需要在辅助病毒的帮助下才能发挥作用。而重组腺相关病毒从野生型腺相关病毒改造而来,传递基因时不需要辅助病毒,已被广泛用于基因编辑系统的体内和体外递送。有研究表明,在某些情况下,用腺相关病毒载体递送基因编辑工具的效率高于整合酶缺陷型慢病毒载体[2],且递送CRISPR基因编辑工具时可以实现持久的编辑[6]。然而,这类编辑系统的应用也存在一系列的挑战,如重组腺相关病毒载体所能荷载的基因组大小有限,仅5.0 kb左右,使用时需要控制“货物”的大小;同时,它的持久编辑功能可能导致CRISPR/Cas工具过表达,造成脱靶效应;此外,还可能会带来免疫原性问题,引发一些免疫毒性[6]。
腺病毒载体
腺病毒载体是一种含双链DNA的病毒,由于感染能力较强、基因不整合到宿主细胞等优点,是目前临床上最常用的基因治疗病毒载体。第一项用于人体的基因编辑临床试验就是利用的腺病毒载体递送系统。CCR5是存在于T细胞表面的一种可以协助HIV病毒入侵的受体,在体外用携带ZFN基因编辑工具的载体系统敲除CCR5基因后,产生不会被HIV感染的T细胞。自体移植后,抗HIV小分子药物治疗中断后,CCR5敲除的T细胞比正常T细胞存活得更好[7]。
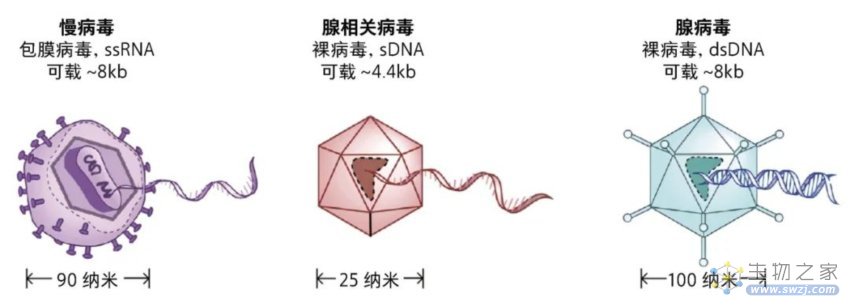
3种病毒载体[7]
非病毒基因编辑递送系统
非病毒介导的基因编辑递送系统尽管基因组编辑酶的效率不如病毒递送方法,但其核酸酶活性具有瞬时优势。更重要的是,与病毒载体不同,非病毒载体可以重复给药,从而提高基因编辑成功的机会。
物理递送方法
通过物理方法破坏细胞膜或使之变形,将基因编辑工具递送到细胞内,常用的物理递送方法有显微注射、电穿孔、微流控等。
显微注射是转染效率极高的一种递送方法,且递送的“货物”大小不受限制,常用于递送核酸类大分子,如用微米级别的针头穿破细胞膜,将可以编码CRISPR/Cas工具的质粒DNA直接注射到细胞中。该方法还可以用于递送mRNA等,从而在胞内表达基因编辑工具[5]。
同显微注射一样,电穿孔也是较为成熟的物理递送方法,通过电场作用增加细胞膜的通透性,从而介导DNA、核糖核蛋白复合物等生物大分子进入。研究显示,与DNA相比,电穿孔方法导入核糖核蛋白复合物时具有更高的效率,且不易形成脱靶。但由于在体内难以控制电穿孔需要的各种参数,该技术目前多被用于体外基因编辑。
基于微流控的技术通过诱导细胞进入小孔径的通道,造成细胞膜的瞬间形变,从而导入与基因编辑工具相关的生物大分子。相对于电穿孔法,这种通过机械变形来改变细胞膜通透性的方法具有更强的安全性,然而效率相对较低[8]。
合成纳米粒递送载体
除物理方法递送基因编辑系统外,人工合成的纳米材料也可以将基因编辑工具递送进细胞内,目前研究较多的纳米粒载体有脂质体类、聚合物等。
脂质纳米粒是一种常见的人工合成基因编辑递送系统,用于基因编辑递送的阳离子脂质体通常由三部分组成:阳离子头部、疏水尾部和两者之间的连接基团[4]。一般情况下,呈电中性的物质更易穿过细胞膜,而阳离子脂质纳米粒不仅以静电结合力将“货物”成功装载,还给“货物”装上了一层电中性的伪装,使得这些生物大分子可以过细胞膜。和病毒载体相似,脂质纳米粒应用范围较广,可用于体内和体外的基因编辑;不同的是,脂质纳米粒免疫原性较弱,相对更为安全[5]。目前,已成功利用脂质纳米粒载体向哺乳动物细胞递送CRISPR/Cas9基因编辑工具。
然而,脂质纳米粒载体在递送过程中也存在一些挑战。首先,纳米颗粒被转入细胞时会被小泡包裹,进一步发展成溶酶体,若所递送的“货物”无法“逃脱”,则会被分解,继而失效。其次,基因编辑工具若无法进入细胞核,则不能真正发挥作用。再次,基因治疗需要在靶细胞中发挥作用[5]。因此,若要实现较高的基因编辑效率,需要对脂质纳米粒载体系统进行相关修饰,如用聚乙烯亚胺改变其荷载能力、用二油酰基磷脂酰乙醇胺增强脂质体的膜融合能力,或用靶向肽增加其靶向能力等。
除了脂质纳米粒载体,以高分子水凝胶纳米颗粒、金纳米粒、石墨烯氧化物、黑磷纳米薄片等材料为基础的人工合成的聚合物也在基因编辑递送方面有所应用[9]。例如,合成能够实现多功能核定位的核壳人工病毒,利用其装载表达CRISPR/Cas9质粒,可实现特定基因的敲除;合成可生物降解的多肽和多糖杂交载体,利用其递送CRISPR/Cas9质粒或mRNA和sgRNA复合物,可靶向巨噬细胞进行基因编辑等。然而,脂质纳米粒和聚合物纳米粒易对细胞造成损害,且存在体内基因编辑效率较低等问题。
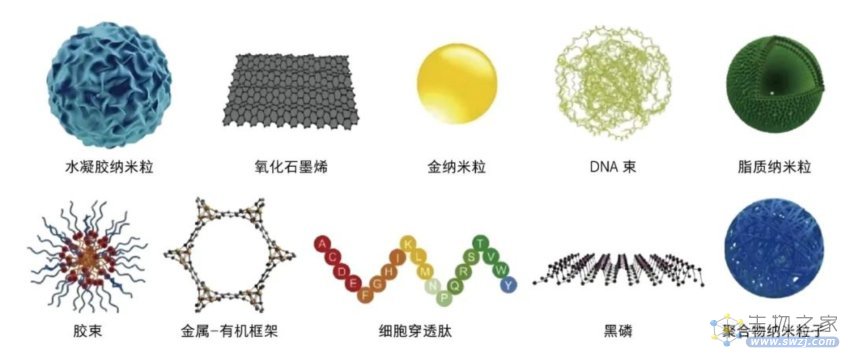
用于基因编辑递送的各种非脂质递送材料[9]
病毒相关基因编辑递送系统
基因编辑效率高的病毒载体存在脱靶和安全性问题,而安全性相对较高的非病毒载体的递送效率又不高。因此近年来,科学家将目光放在了病毒样颗粒上。
病毒样颗粒是指保留了病毒的部分结构(如包膜和衣壳),但不具有病毒基因组的载体系统,可以实现mRNA、蛋白质及核糖核蛋白复合物的胞内递送。目前,病毒样颗粒大多由慢病毒改造而来,其中HIV-1是最常用的慢病毒。Gag蛋白是HIV-1的主要结构蛋白。研究人员用HIV-1蛋白酶剪切连接子将Cas9和Gag蛋白连接起来,利用病毒样颗粒和T细胞之间的亲和力,实现了对T细胞的靶向基因编辑。
相比于传统的病毒载体,病毒样颗粒不包含病毒的遗传物质,不会将外源DNA整合到宿主基因组,也不会引起感染,可能比其他使用实际病毒的递送方法更安全。同时,这种递送系统往往保留和病毒侵染、释放相关的蛋白质,可以达到比较高的递送效率,为基因编辑工具的体内精准应用又增添了一丝曙光。
应用前景和展望
目前,大量基于基因编辑的治疗方法正在全球范围内开展临床试验,为癌症、心血管疾病、神经病变、代谢类疾病、眼部疾病等疑难杂症提出了许多潜在的治疗方案。美国研发的NTLA-2001基因编辑疗法在治疗转甲状腺素蛋白淀粉样变性患者的临床I期试验中,取得了令人振奋的结果;Editas公司开发的基因编辑疗法EDIT-301也在进行人体临床研究,有望治疗镰状细胞病与输血依赖性β地中海贫血症;基于CRISPR技术改造的CAR-T细胞疗法CTX110得到美国FDA授予的再生医学先进疗法认定,用于治疗复发或难治性CD19+B细胞恶性肿瘤。
基因编辑技术有巨大的临床应用潜力,然而,想要将这把“手术刀”安全地用于治疗时,仍有许多问题需要解决。例如,有些疾病涉及的细胞更新速度很快,而目前的基因编辑技术多用于可以持久发挥疗效的永生细胞;治疗有些疾病时需要编辑大量的基因,而目前的基因编辑递送技术无法实现这样的效率;基因编辑递送方法众多,但并没有哪种方法是绝对完美的,仍需要去选择平衡其编辑效率、安全性和靶向性。不过,基因编辑递送系统的发展速度十分迅速,我们有理由相信,未来会有更多精准、有效、安全的基因编辑疗法出现,越来越多的疾病将找到合适的治疗方法。
杨嘉敏,硕士研究生;平渊,教授:浙江大学药学院,杭州 310058。pingy@zju.edu.cn
Yang Jiamin, Master Degree; Ping Yuan, Professor: College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058.
[1]Lander E S. The heroes of CRISPR. Cell, 2016.
[2]Yin H, Kauffman K J, Anderson D G. Delivery technologies for genome editing. Nature Reviews Drug Discovery, 2017,16(6): 387-399.
[3]Yan X, Pan Q, Xin H, et al. Genome-editing prodrug: Targeted delivery and conditional stabilization of CRISPR-Cas9 for precision therapy of inflammatory disease. Science Advances, 2021,7(50): j624.
[4]Yin H, Kanasty R L, Eltoukhy A A, et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics, 2014,15(8): 541-555.
[5]Lino C A, Harper J C, Carney J P, et al. Delivering CRISPR: a review of the challenges and approaches. Drug Deliv, 2018, 25(1): 1234-1257.
[6]Wang D, Zhang F, Gao G. CRISPR-based therapeutic genome editing: Strategies and in vivo delivery by AAV vectors. Cell, 2020, 181(1): 136-150.
[7]van Haasteren J, Li J, Scheideler O J, et al. The delivery challenge: fulfilling the promise of therapeutic genome editing. Nature Biotechnology, 2020, 38(7): 845-855.
[8]Han X, Liu Z, Jo M C, et al. CRISPR-Cas9 delivery to hard-to-transfect cells via membrane deformation. Sci Adv, 2015, 1(7): e1500454.
[9]Wan T, Niu D, Wu C, et al. Material solutions for delivery of CRISPR/Cas-based genome editing tools: Current status and future outlook. Materials Today, 2019, 26: 40-66.































