“CRISPR最初是一个好奇心驱动的基础研究项目,现在已成为无数研究人员使用的突破性策略,并能够帮助改善人类健康状况。”
——詹妮弗·杜德纳(Jennifer A. Doudna)博士
2020年,诺贝尔化学奖授予了两位“发现能对基因组进行编辑的方法”的女性科学家——詹妮弗·杜德纳博士和伊曼纽尔·沙彭蒂埃(Emmanuelle Charpentier)博士,这是诺贝尔奖历史上首次仅由两名女性科学家共同分享同一奖项。对此,詹妮弗·杜德纳博士认为这传递了一个重要的信息:"女性也很了不起"。
她们的科学发现——CRISPR-Cas9基因编辑技术的确很了不起。这把“基因剪刀”让科学家们能够以前所未有的效率和精度修改任何生物体中的遗传密码(即DNA),为生物学、农业和医学等领域的突破带来了更多的可能性。尤其是在医学领域,基因编辑技术能够精确地“修正”错误的DNA,从而治疗遗传性疾病和其它疾病。
就在半个月前,基于CRISPR-Cas9技术的基因编辑疗法Casgevy在英国获批上市了,它是全球首款获批上市的CRISPR基因编辑疗法。Casgevy的上市标志着CRISPR-Cas技术完成了从最初的基础科学发现到临床应用的完整转化,达到了生物医药发展史上的又一里程碑。在这个历史性的时刻,药明康德内容团队将结合公开资料,从该技术的发明者之一杜德纳博士的视角出发,带大家一道回顾CRISPR-Cas9基因编辑技术的发现过程。

▲Jennifer A. Doudna博士(图片来源:药明康德内容团队制作)
师从两位诺贝尔奖得主的幸运女孩
詹妮弗·杜德纳于1964年2月19日出生于美国华盛顿,然后在夏威夷的一个小镇上度过了她大部分的青葱岁月。尽管家里人没有一个从事的是科研相关行业,杜德纳从小就对数学和自然科学着迷。在上大学时接触到生物化学后,她便一发不可收拾地燃起了对从事科学研究的激情,然后全力奔赴自己的梦想——成为一名化学家。
1985年,杜德纳在本科毕业后如愿进入了哈佛大学的研究生院,并幸运地加入了美国生物化学家和遗传学家杰克·索斯塔克(Jack W. Szostak)博士的实验室。那时,索斯塔克博士刚刚因发现了端粒和端粒酶对染色体的保护作用而名声大噪,这一发现后来为他摘得了2009年诺贝尔生理学或医学奖的桂冠。然而,索斯塔克博士不喜欢在热门研究上扎堆,在端粒研究领域开始变得火热后,他积极转型,开始探索新的研究方向——RNA和RNA在进化中的作用。于是在索斯塔克博士的实验室里,杜德纳正式开始与RNA打上了交道,并于1989年获得了生物化学博士学位。
杜德纳的博后经历同样幸运,她进入了科罗拉多大学托马斯·切赫(Thomas R. Cech)博士的实验室做博后。切赫博士那时已是一名诺奖得主,他因“发现了RNA的催化特性”获得了1989年的诺贝尔化学奖。与两位在RNA领域颇有建树的科学家一同工作学习的经历为杜德纳培养了良好的科学素养,同时也为她日后专攻RNA生物学打下了坚实的基础。
迷上奇妙的细菌“免疫系统”
2002年,杜德纳受聘在加州大学伯克利分校担任生物化学和分子生物学教授。最开始,杜德纳的目标是推导出RNA的三维结构。但在研究某些小RNA如何能控制遗传信息的问题时,她开始对一种从细菌中发现的“免疫系统”产生了兴趣。
上个世纪90年代左右,科学家们从古细菌的基因组里发现了许多奇怪的“回文”片段。这些片段长30个碱基,而且会不断重复。在两段重复之间,有长约36个碱基的间隔。对于这种具有规律性的重复,科学家们后来给它起了一个拗口的名字“常间回文重复序列簇集”(Clustered Regularly Inter-Spaced Palindromic Repeats),也就是我们现在所熟知的那个简称——CRISPR。
一开始,科学家们并不知道这些CRISPR序列到底有什么作用,但随着众多科学家不断发现重要线索,对CRISPR序列作用的猜想开始逐渐变得完整。首先是西班牙的微生物学家弗朗西斯科·莫伊卡(Francisco Mojica)教授做出的重要发现。
莫伊卡教授的研究结果表明,CRISPR序列能让细菌记住入侵的噬菌体(一种能感染细菌的病毒)的“模样”,从而使细菌能够抵御这种病毒的再次感染。这与人类的免疫系统何其相似!在人体里,免疫系统会记住过去遇到过的病原体,等到病原体再次入侵时,免疫系统就会迅速识别并对其发起攻击。但细菌是一种单细胞生物,它如何能在1个细胞内复制人类这套复杂免疫系统的作用呢?这个难题曾让众多科学家百思不得其解,却也激发起了更多人的挑战欲。
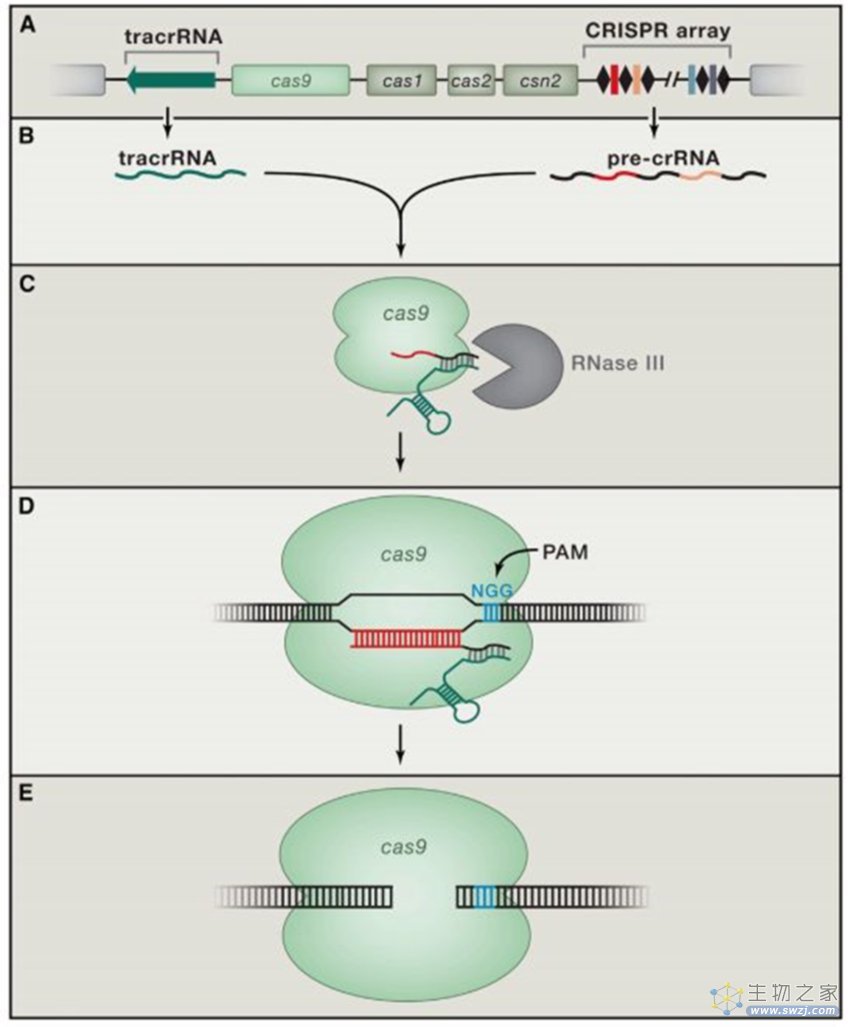
▲一种微生物体内的CRISPR系统的工作原理(图片来源:参考资料[5])
随后,一些科学家在莫伊卡教授的基础上对CRISPR序列的作用做了进一步的推测,其中也包括杜德纳的同事。将所有科学家们发现的线索进行整合后他们认为,CRISPR是一种起源于入侵病毒的RNA序列。在病毒感染细菌后,细菌会切割病毒的基因组整合到自己的基因组中,从而“记住”病毒,等类似的病毒再次入侵,带有这些病毒DNA片段的RNA拷贝(就好比病毒的“通缉海报”)的酶会与这些入侵者进行比对,如果新入侵的病毒DNA与”通缉海报“对上了,就会触发切割病毒DNA的指令,从而杀死病毒。还有一些科学家认为,一种名为Cas9的蛋白很可能就是病毒DNA的切割器,但当时还没有人能证明这一点。
在听同事分享CRISPR研究进展的过程中,杜德纳也对CRISPR系统使细菌能够成功抵御病毒感染的机制产生了好奇,并积极开展了研究。2008年,她在CRISPR RNA链和Cas1蛋白上的初步研究获得了认可,并得到了资助。
2011年,一名法国微生物学家伊曼纽尔·沙彭蒂埃博士发表在《自然》杂志上的一篇论文引起了她的注意。论文中描述了一种在其它CRISPR系统中未曾发现过的特殊RNA——tracrRNA,并揭示了这种RNA究竟是如何与Cas9蛋白一起生成病毒的“通缉海报”的。那时的杜德纳并没有想到,不久后她就会与沙彭蒂埃博士结识,她们革命性的发现将开创基因组学的新时代。
接力式工作,“基因剪刀”诞生
2011年春天,身为微生物学家的沙彭蒂埃博士理所当然地受邀参加了美国微生物学会主办的一场会议。杜德纳的研究原本与微生物关系不大,但由于会议上有一场关于CRISPR的报告,在该领域已有一定成果的杜德纳也受到了邀请。
幸运女神似乎十分眷顾杜德纳,在朋友的引荐下,她见到了《自然》杂志上那篇有关CRISPR系统作用机制的论文的作者——一位个头娇小、外表时尚且魅力十足的法国女科学家。沙彭蒂埃博士对杜德纳的初见印象也很好,俩人一见如故,在会后散步的途中就迅速达成了合作破解CRISPR系统机制之谜的意向。
由于不在同一个国家,加上两边还有9小时的时差,杜德纳和沙彭蒂埃博士后续的合作全靠邮件沟通,但这也使得她们能保持7乘24小时的全天候工作状态。当杜德纳睡觉时,沙彭蒂埃博士就起床工作,而第二天杜德纳起床时,沙彭蒂埃博士新一轮的反馈就来了。就在这样紧凑的接力式工作状态下,仅仅花了一年的时间,两位科学家的合作有了突破性的成果。2012年,她们在《科学》杂志上共同发表了在CRISPR基因编辑领域上具有里程碑意义的重要论文。
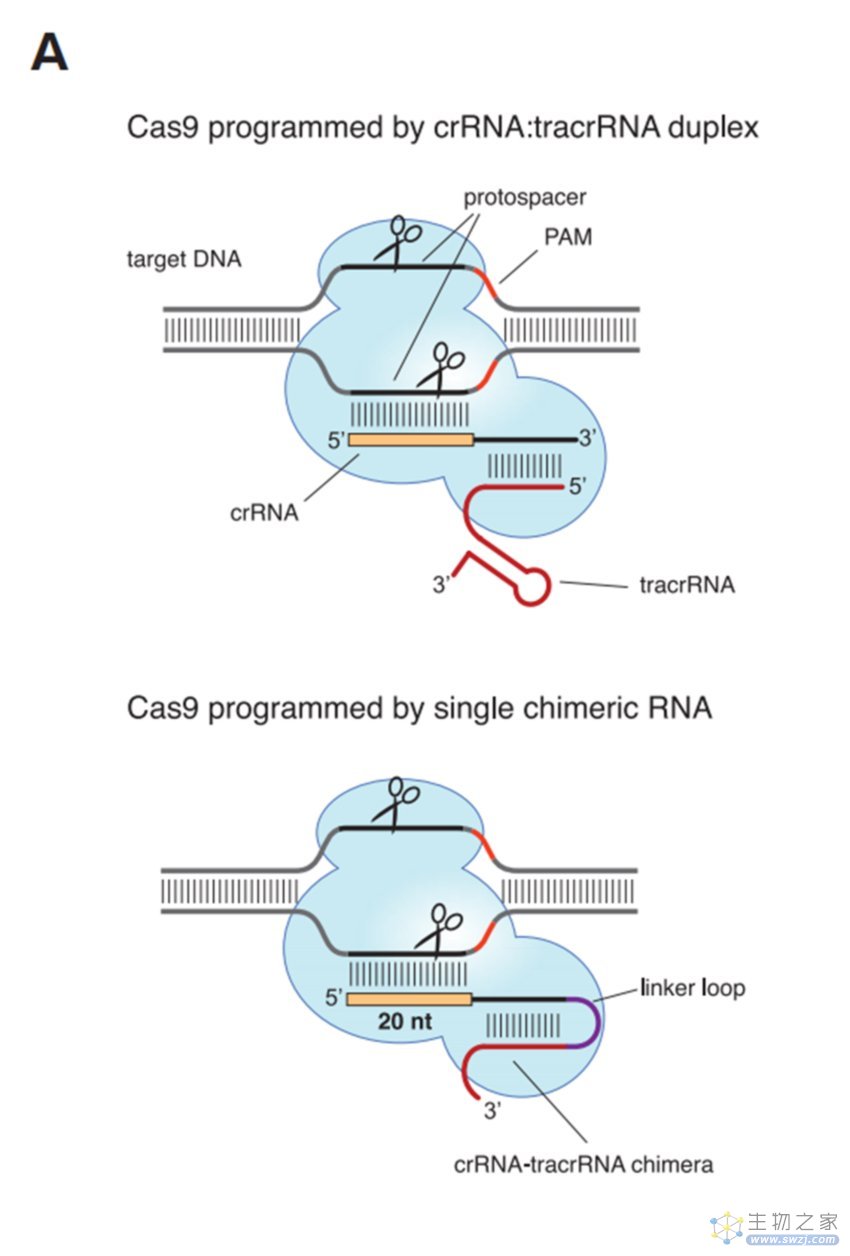
▲Emmanuelle Charpentier教授与Jennifer Doudna教授报道的CRISPR基因编辑系统(图片来源:参考资料[7])
她们的研究表明,Cas9蛋白同时受tracrRNA和与病毒序列匹配的CRISPR RNA(crRNA)的引导,并能利用它们来寻找和破坏匹配的病毒DNA。更重要的是,她们还成功将tracrRNA和crRNA整合成了1个RNA嵌合体,这种RNA嵌合体同样可以让Cas9蛋白指哪儿打哪儿,精确定位并剪切任何物种中的任何基因。也就是说,她们开发的这种CRISPR-Cas9基因编辑系统将成为一种能够编辑植物或动物基因组(包括人类基因)的强大工具,使高效、精准地删除或添加特定的DNA链成为可能!“基因剪刀”就此诞生了。

▲张锋教授团队也报道了CRISPR基因编辑系统的重要应用(图片来源:参考资料[9])
很快,这把使用简单的“基因剪刀”就在实验室中展现出了惊人的实力。2013年新年伊始,《科学》杂志再度刊登了一篇关于CRISPR系统的重磅文章。这一次,主导这项研究的是Broad研究所的张锋教授。论文里,科学家们首次将CRISPR技术应用到了哺乳动物细胞内,并证明它能在短短几周之内就建立起小鼠的疾病模型。随后,张锋教授团队也首次在人类细胞中成功使用CRISPR-Cas系统完成了基因编辑。
CRISPR-Cas基因编辑技术的后续发展
自2012年杜德纳博士和沙彭蒂埃博士首次发表具有里程碑意义的论文以来,科学家们对CRISPR基因编辑技术进行了大量的优化与改造。一方面,现在的CRISPR基因编辑技术可以变得更精准,带来更少的脱靶效应(指修改了不应修改的基因);另一方面,CRISPR系统也已经超越了DNA,能够对RNA进行有效编辑。
此外,初代的CRISPR技术涉及DNA双链的断裂,会引起潜在的风险。如今,科学家们基于CRISPR体系,已经开发出了“单碱基”基因编辑系统,能够对基因进行“微调”。如果说以前的基因编辑,是把书的一页纸撕下,再粘上一页新的纸的话,这种“单碱基”基因编辑系统,就好比把书页上的错别字给单独修改,有着更高的精度。
现在,CRISPR基因编辑技术几乎已被应用到生物医学领域的各个角落。尤其是在治疗遗传疾病、传染病和癌症方面,该技术使科学家们能够设计模仿人类疾病的实验动物,以了解遗传缺陷致病的原因,同时测试通过精确改变DNA以纠正遗传缺陷的治疗方法。
截至目前,除了刚刚获批的Casgevy,全球还有十余款CRISPR基因编辑疗法已经进入临床试验阶段(不含研究者发起的临床研究),其中包含了多款中国公司开发的产品。从疾病领域来看,这些疗法的应用范围正在从治疗遗传性疾病扩展到慢性疾病,如心血管疾病、HIV感染等,并有望在将来展现出更广泛的应用前景。对于该领域的繁荣景象,杜德纳博士表示:“这十分令人兴奋!虽然编辑基因组的能力是一种强大的工具,但我认为我们当中没有人能想象该领域会发展得如此迅速。”
如上文所述,一项技术的发明者固然重要,但想要整个领域获得迅猛的发展和突破性的进步,往往不是依赖一两名科学家的“尤里卡时刻”就能实现的。没有后续研究者的积极推动,CRISPR基因编辑技术的发展或许将会大幅度推迟,甚至可能无法取得如今的成果。正是因为有无数科学家们的智慧和努力汇聚在一起,才使得CRISPR技术得以不断完善和发展,也让我们有幸在一项创新技术被发明后的短短十余年时间内就见证了首个转化疗法的获批。在这里,让我们向所有参与其中的科学家们致以崇高敬意!我们期待未来,这些科学家们能够继续为人类健康、生物科学等领域带来更多的惊喜和突破。































