近年来,CAR-T疗法获得了巨大的成功,成为治疗恶性血液病(HMs)的一种潜在疗法。2017年,Tisagenelecleucel(CTL019,Novartis)被美国食品和药物管理局(FDA)批准用于治疗复发或难治性(R/R)急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL),同时,Axicabbtagene-ciloleucel(KTE-C19,Kite Pharma)被批准用于NHL。
在过去的九年里,中国越来越多的临床试验旨在评估CAR-T疗法的安全性和有效性。中国已超越美国成为CAR-T疗法临床研究的主要力量。除了CAR-T细胞治疗临床试验的大幅增长外,中国研究人员还在产品开发和临床前研究方面取得了进展,包括新靶点设计、功能增强、精确调控、通用CAR-T细胞以及不同免疫细胞源的细胞转化。此外,中国政府在过去7年中颁布的许多细胞治疗政策,包括金融支持和逐步完善的监管体系。
目前,中国在CAR-T疗法创新策略方面发挥着不可或缺的作用。鸡尾酒疗法和多靶点CAR-T治疗的概念扩大了肿瘤抗原的覆盖范围,提高了肿瘤细胞的清除率。此外,CAR-Ts可以与干细胞联合使用,为更有效的CAR-T疗法铺平道路。
1、中国CAR-T临床试验概况
截至2021 11月15日,中国已注册了714项CAR-T细胞治疗临床研究,其中510项临床试验在ClinicalTrials.gov上注册,204项在中国临床试验注册中心。
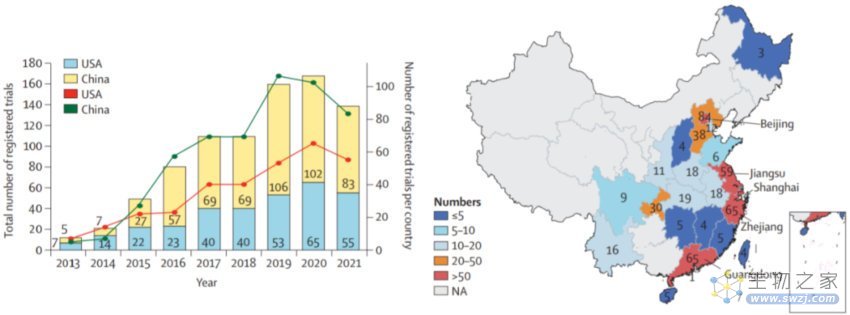
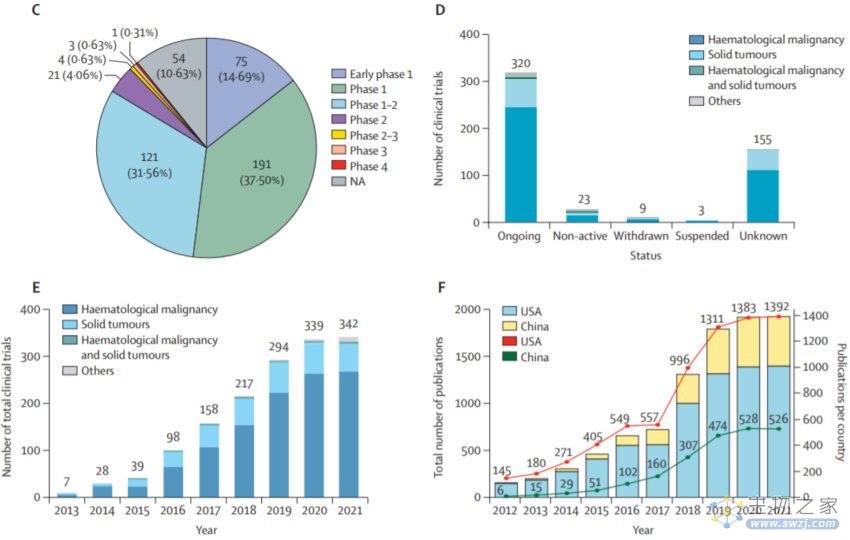
目前,进行CAR-T细胞治疗的研究中心主要集中在拥有先进基础设施的中国东部沿海经济城市,如北京(n=84)、广东(n=65)、浙江(n=65)、江苏(n=59)和上海(n=54)。320项涉及CAR-T细胞治疗的临床研究正在进行中,其中大多数(约70%)仍处于1期或1/2期。同时, CAR-T细胞相关研究论文也出现了平行增长。在某种程度上,高频率的发表与试验比率反映了参与CAR-T细胞研究的中国医生和科学家在临床转化方面所做的努力。
2、CAR-T的结构和靶标
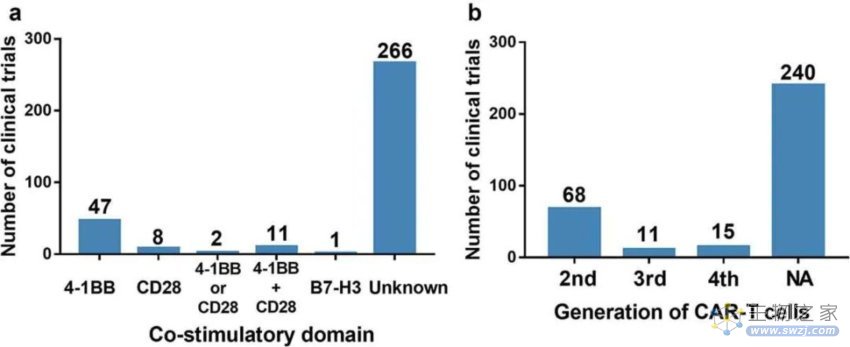
在中国注册的试验都没有使用第一代CAR,相比之下,第二代CAR是目前最受欢迎的选择,其次是新颖的第四代(4SCARs)和第三代。最常见的共刺激域是4-1BB,其次是CD28和4-1BB的组合。
与全球应用一致,CAR-T细胞疗法在中国已广泛应用于血液学恶性肿瘤,尤其是B细胞恶性肿瘤。
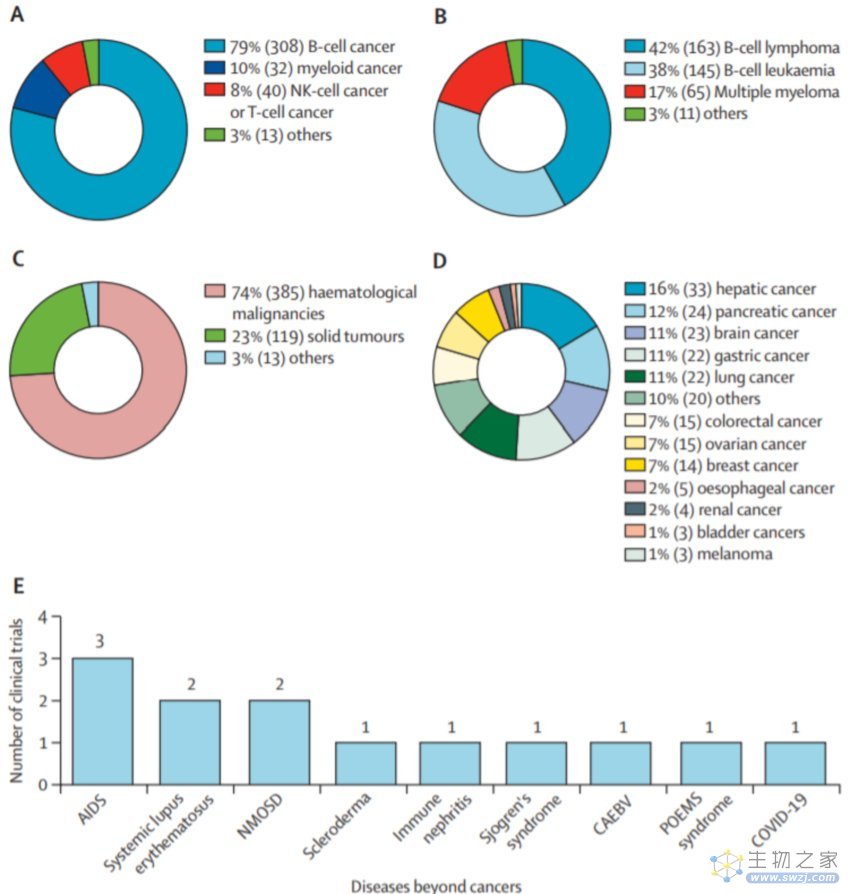
此外,中国的研究人员一直在积极扩展CAR-T细胞的适用临床背景,342项试验中有13项(3%)登记了肿瘤以外的疾病,119项(23%)登记了实体瘤。CAR-T细胞疗法中最常试验的实体肿瘤包括肝癌、胰腺癌和脑癌,而非恶性疾病涵盖范围更广,包括自身免疫性疾病、传染病和POEMS综合征。具体而言,针对自身免疫性疾病的CAR-T细胞试验包括系统性红斑狼疮、硬皮病、肾炎、干燥综合征、视神经脊髓炎谱系障碍,以及针对感染性疾病的CAR-T细胞试验,包括艾滋病、慢性活动性EB病毒感染和新冠肺炎。
3、CAR-T细胞疗法在中国快速扩张的关键驱动因素
积极的政策和法规
在《中华人民共和国经济和社会发展第十三个五年计划(2016-2020年)》中,明确提出扩大基因组学和其他生物技术在生物医学研究领域的应用。随后,国务院于2016年11月29日发布的《国务院关于印发国家“十三五”战略性新兴产业发展规划的通知》中明确强调,要加快包括细胞治疗在内的生物技术产业的创新和发展步伐。在国家级政策的指导下,相关部委颁布了促进细胞疗法发展的法规。
随后,NMPA发布了一系列法规和指南,包括化学、制造和控制、临床前研究和临床研究。随着开发中的药物数量快速增长,申请的细胞治疗产品数量也迅速增加,并且随着NMPA批准了多个细胞治疗产品的研究新药申请,这加快了开发和制造过程。
2019年,在与NMPA协商后,国家卫生委员会发布了《体细胞治疗临床研究和转化应用管理办法》草案,该草案允许通过医疗单位在提交药品审理前以临床前研究获取数据支持药物注册,这一政策大大加快了中国细胞治疗产品研究新药开发的步伐。
充足的资金支持
自2015年国务院发布《关于改革药品和医疗器械审评审批流程的意见》以来,中国生物技术行业开始快速开发CAR-T细胞产品,资本和资金不断增加。香港联交所于2018年发布了18A上市政策,允许创收前生物技术公司在满足特定条件后注册。此外,中国A股市场于2019年发布了科技创新委员会政策,并于2021发布了北京证券交易所政策,以鼓励并允许盈利前的科技公司公开上市。在这种开放政策的推动下,开发细胞治疗产品的公司看到了融资的强劲增长。2018年至2021,中国细胞治疗公司累计筹集资金23.7亿美元,年复合增长率为45%,公开宣布的金融交易109笔。
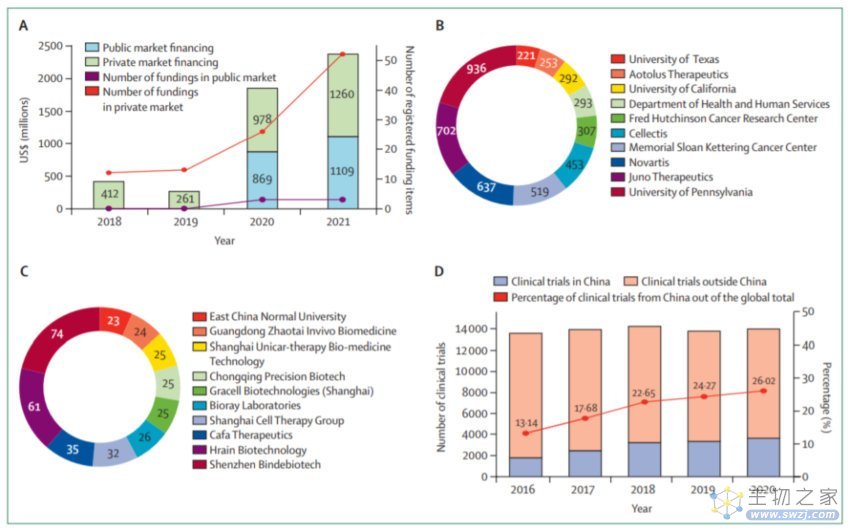
在充足的研究资金支持下,中国细胞治疗公司迅速发展,并在该领域发挥着重要作用。与美国相比,美国的研究机构申请了大部分专利,而中国十大CAR-T细胞相关专利申请人中,有九家是私营公司。
庞大的患者群和快速成长的临床试验系统
中国有14亿人口,拥有全球最大的患者群体。在过去的15年中,患者对临床试验的意识不断提高,患者的参与也在增加。中国的临床试验数量从2016年的1793项增加到2020年的3698项,复合年增长率为19.8%。此外,参与中国临床试验的研究人员数量从2016年的4855人增加到2020年的7149人,复合年增长率为10.2%。
4、中国CAR-T治疗的新进展
新靶标
在血液肿瘤学领域,新的靶标不断出现。然而,具有单一靶点的CAR-T细胞通常会遇到抗原逃逸和复发的问题。具有双重靶点的CAR-T细胞可以通过更准确地靶向肿瘤细胞来克服这些缺点,并在各种血液学恶性肿瘤甚至实体肿瘤中提供更好的临床疗效和安全性。
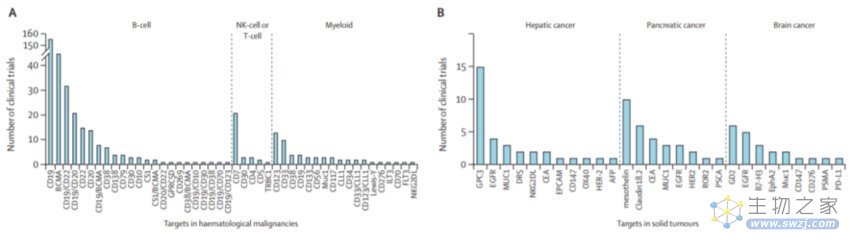
在实体瘤中,CAR-T细胞治疗的新靶点也正在出现。在GPC3靶向CAR-T细胞治疗肝细胞癌的第一次全球临床试验中,在接受抗GPC3 CAR-T细胞治疗后,13名GPC3阳性的晚期肝细胞癌患者中有两名(15%)获得了部分缓解,总体中位生存时间明显延长。
然而,CAR-T细胞治疗的靶点研究主要集中于先前已知靶点在人类中的首次应用和扩展适应症,新靶标的开发和基础研究仍然是中国的主要缺点。
增强的功能
提高CAR T细胞功效的一种方法是增强其功能,中国科学家为此做出了几项贡献。
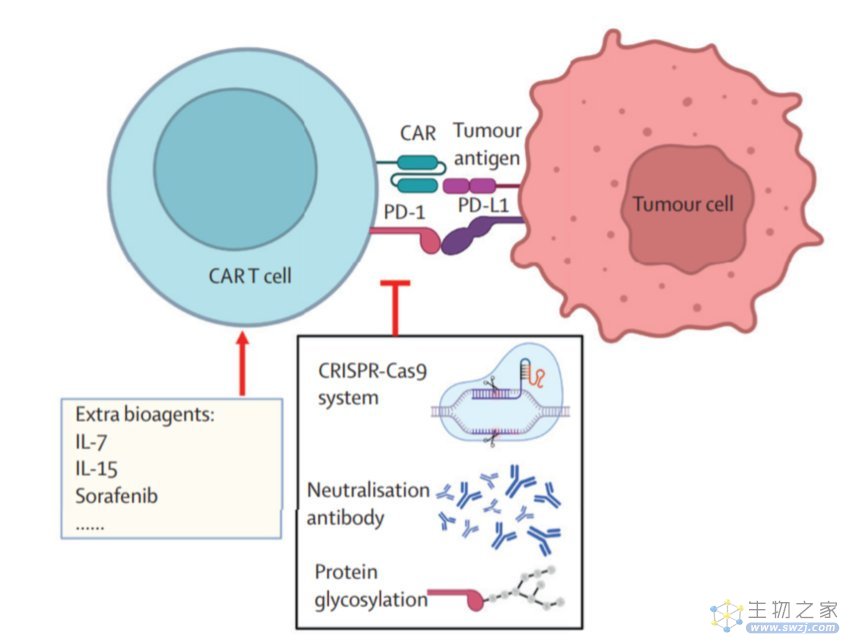
首先,中国科学家通过设计具有更多共刺激分子的第三代CAR来改善CAR-T细胞;第二个改进是通过阻断免疫检查点受体;第三个改进是通过各种其他生化修饰来增加CAR-T细胞的抗肿瘤特性;第四项改进是通过研究药物和CAR-T细胞的组合策略;第五项改进是通过体外培养的新方案;最后,通过鸡尾酒CAR-T细胞疗法,抗CD19 CAR-T细胞和抗CD22 CAR-T细胞的连续输注改善了复发或难治性B细胞急性淋巴细胞白血病患者的长期缓解。
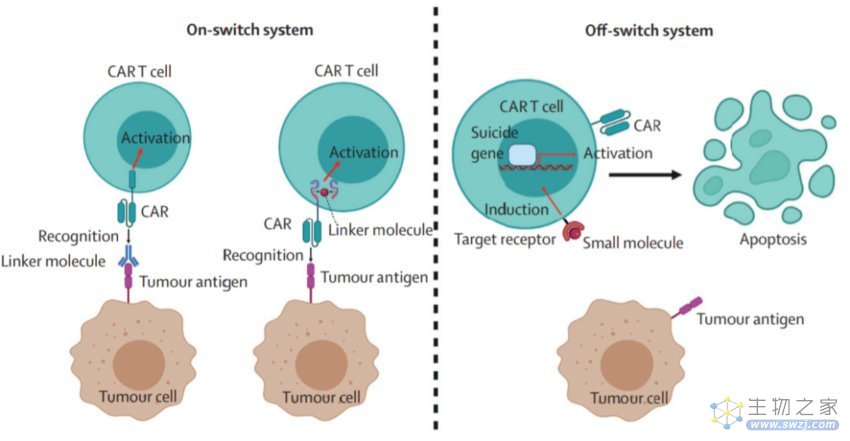
提高安全性
尽管CAR-T细胞疗法在血液学恶性肿瘤的疗效方面取得了突破,但严重的副作用阻碍了其广泛发展。为了减少这些不良反应,研究人员提出了各种安全策略。安全开关的CAR-T细胞旨在通过抗体或小分子药物抑制过度激活,从而避免严重的副作用。引入诱导性自杀基因是另一种提高安全性的常见策略,例如编码单纯疱疹病毒胸苷激酶、截短的表皮生长因子受体、诱导性Caspase9(iCasp9)和RQR8的CAR。此外,研究人员根据合成生物学原理设计了含有不同抗原识别模式受体结构的CAR-T细胞,如合成Notch受体、抑制性CAR和基于亮氨酸拉链的通用CAR。
异基因CAR-T
中国在开发异基因CAR-T细胞方面取得了许多成就,包括安全性和有效性得到改善的临床结果。中国研究人员开发了一种通用的抗CD19–CD22 CAR-T细胞产品,该产品具有CRISPR-Cas9破坏的TRAC区和CD52基因,以避免GVHD。1期临床试验结果显示,6例复发或难治性B细胞急性淋巴细胞白血病患者中,有5例(83%)在输注CAR-T细胞28天后出现完全缓解。但所有患者都出现细胞因子释放综合征。
此外,另一项研究报告了CD7靶向现成同种异体CAR-T细胞产品(GC027)在复发或难治性T细胞急性淋巴细胞白血病患者中的临床结果。通过CRISPR-Cas9基因编辑方法破坏GC027中T细胞受体α和CD7的表达,以防止GVHD。6名患者中的5名(83%)完全缓解,但所有患者都有严重的细胞因子释放综合征。
目前,虽然在UCAR-T细胞方面取得了实质性成就,但在安全性和有效性方面仍存在一些局限性。这些局限性值得未来进一步研究和改进。
5、多能干细胞衍生细胞疗法
在iPSC衍生的细胞免疫疗法中,中国学者也正在取得稳步进展。中国有许多公司正在开始研发多能干细胞衍生的细胞免疫疗法,开展研究者发起的试验,并申请新药注册。迄今为止,基于人类干细胞的临床试验数量每年都在增加,目前已有88项临床试验注册。
展望
CAR-T疗法在中国发展迅速,显示出可管理的安全性和显著的疗效。从数量上讲,中国的试验数量是世界上最多的,扩大了疾病和靶抗原的覆盖范围。此外,中国研究人员致力于探索CAR结构和CAR-T疗法的创新用途,包括人源化或全人源CARs、带有“安全开关”的CARs、多靶向CARs和通用CAR-T等,可提高CAR-T的疗效并降低其毒性。这些创新使CAR-T细胞疗法成为一种强大而有前途的细胞免疫疗法,有可能惠及中国和全球广大癌症患者。随着实验室研究的扩大,中国也走在了临床研究的前沿,未来可以预见将有越来越多的CAR-T细胞产品进入新药开发的临床研究阶段。
参考文献:
1. CAR-T cells: the Chinese experience. Expert Opin Biol Ther. 2020 Nov;20(11):1293-1308.
2. CAR T-cell therapies in China: rapid evolution and a bright future. Lancet Haematol.2022 Dec;9(12):e930-e941































