多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
铁死亡(Ferroptosis)是2012年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式【1】。铁死亡由铁依赖性磷脂过氧化所引起,导致质膜破裂和最终的细胞死亡。由于磷脂过氧化是正常细胞代谢和细胞经常遇到的各种应激的自然结果,因此,细胞需要监测机制来防止不必要的铁死亡。
目前已知有两种铁死亡监测机制,一种是由谷胱甘肽过氧化物酶4(GPX4)介导的,通过将磷脂过氧化物还原为相应的磷脂醇来防止铁死亡;另一种是由FSP1、DHODH、NOS2、GCH1等酶介导的,这些酶产生具有自由基捕获抗氧化剂(RTA)活性的代谢物,从而终止磷脂过氧化,抑制铁死亡。
越来越多的证据表明,诱导癌细胞的铁死亡可作为一种有潜力的癌症治疗手段。因此,了解铁死亡的机制对基础生物学研究和人类疾病治疗都有着重要意义。确定细胞中是否存在独立于GPX4和RTA的额外的铁死亡监测机制尤为重要,因为癌细胞可能利用这些新机制来逃逸铁死亡,反过来,这些新机制也可以为开发癌症疗法提供新靶点。
2023年6月1日,纪念斯隆凯特琳癌症中心姜学军教授团队(梁德光博士为第一作者)在 Cell 期刊发表了题为:Ferroptosis surveillance independent of GPX4 and differentially regulated by sex hormones 的研究论文。
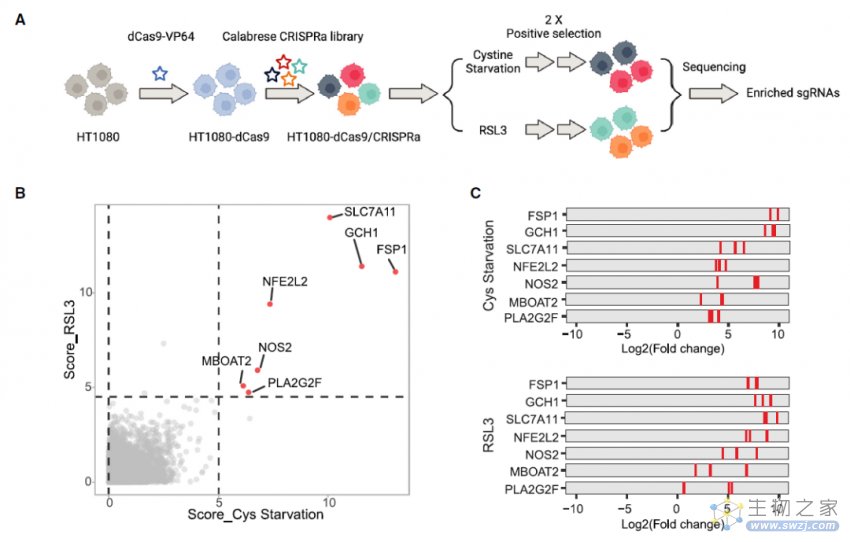
该研究通过全基因组CRISPR激活筛选发现MBOAT1和MBOAT2是新的铁死亡抑制因子,它们通过重塑磷脂来抑制铁死亡,这是一种独立于GPX4或FSP1的新型铁死亡监测机制。
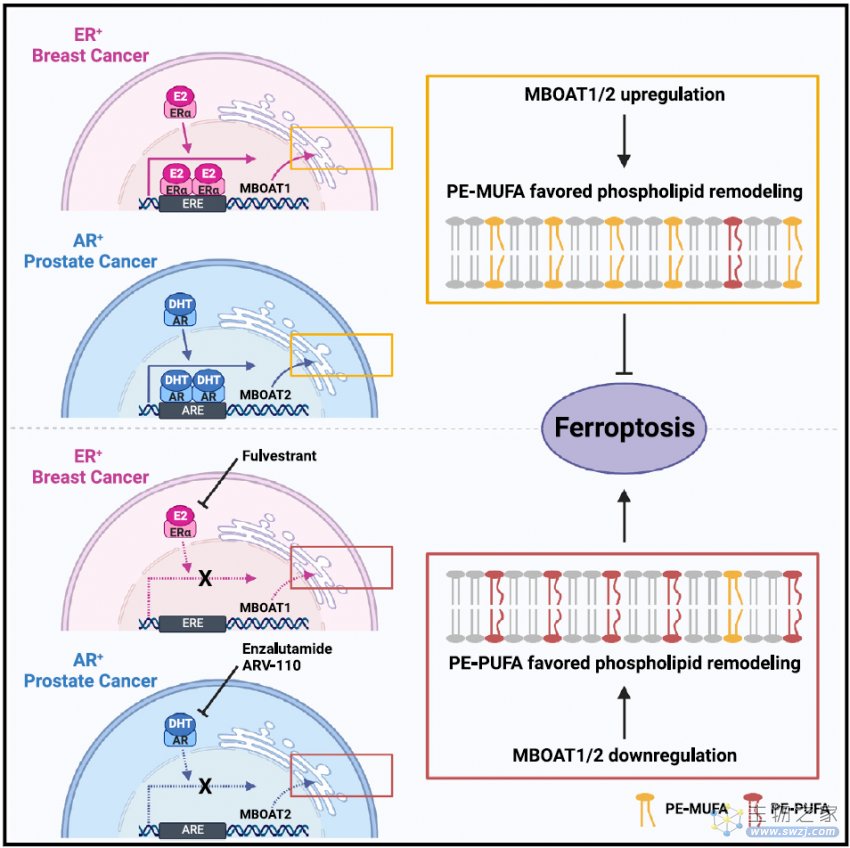
该研究还发现,MBOAT1和MBOAT2分别受到雌激素受体(ER)和雄激素受体(AR)的转录上调。ER或AR拮抗剂联合铁死亡诱导,可显著抑制ER阳性乳腺癌或AR阳性前列腺癌的生长,这为治疗具有特定遗传背景的癌症提供了新的思路。

在这项研究中,研究团队利用全基因组CRISPR激活筛选(whole-genome CRISPR activation screen)及进一步的机制研究,鉴定到了膜结合O-酰基转移酶2(MBOAT2)是一种新的铁死亡抑制基因。
研究团队证明了MBOAT2能够选择性地将单不饱和脂肪酸(MUFA)转化为溶血磷脂酰乙醇胺(lyso-PE),从而增加含单不饱和脂肪酸的磷脂酰乙醇胺(PE-MUFA),并相应减少含多不饱和脂肪酸的磷脂酰乙醇胺(PE-PUFA)。由于PE-PUFA是磷脂过氧化的首选底物和铁死亡敏感性的主要决定因素,因此,MBOAT2可以有效地抑制铁死亡。
更重要的是,MBOAT2可以独立于GPX4和FSP1,通过磷脂重塑的新机制介导铁死亡监测。研究团队还进一步发现,MBOAT1可以通过类似机制抑制铁死亡。
值得注意的是,MBOAT2和MBOAT1分别被雄激素受体(AR)和雌激素受体(ER)直接上调。
雄激素受体(AR)抑制剂恩杂鲁胺(enzalutamide),以及雄激素受体(AR)的PROTAC降解剂ARV-110,都可以通过下调MBOAT2的表达,使AR阳性前列腺癌细胞铁死亡。而雌激素受体(ER)拮抗剂氟维司群(Fulvestrant),能够通过下调MBOAT1的表达,使ER阳性乳腺癌细胞铁死亡。
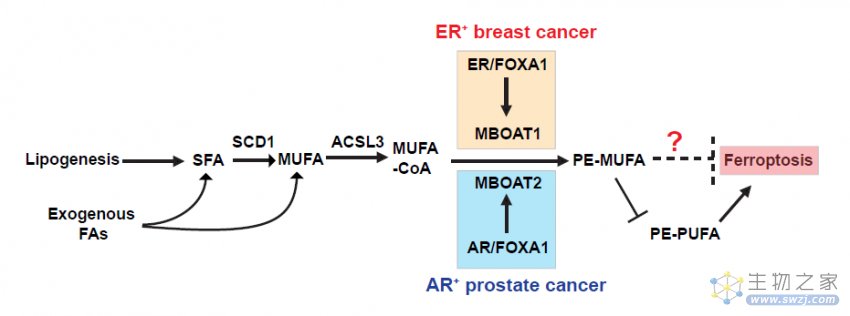
总的来说,这项研究证明了性激素信号通过MBOAT1/2介导的磷脂重塑抑制癌细胞的铁死亡,为治疗具有特定遗传背景的癌症提供了新的思路。

姜学军教授(左),梁德光博士(右)
姜学军实验室主要研究与癌症生物学高度相关的两个方向:1)程序性细胞死亡过程(包括细胞凋亡和铁死亡)的分子基础及其在人类疾病中的作用;2)细胞自噬的分子基础及其在癌症中的作用。实验室还研究各种癌症信号和细胞代谢事件。实验室目标是将基础研究成果转化为潜在治疗方法。
论文链接:
1. https://doi.org/10.1016/j.cell.2012.03.042
2. https://doi.org/10.1016/j.cell.2023.05.003































