如何最有效的拯救癌症患者?这是每一个癌症临床医生或相关科研人员经常思考的问题。
手术、放疗、化疗,以上三种是我们之前最常听到的治疗癌症的方法,近些年来,随着科学技术的飞速发展,靶向治疗、免疫疗法相继出现在了人们眼前,前者适用于有明确致癌驱动基因的癌症患者,虽然其效果较好,但就目前来说并不是每种癌症都有相应靶向药物,这大大的限制了其应用。后者的主要目的是激活人体免疫系统,依靠自身免疫机能杀灭癌细胞和肿瘤组织。免疫疗法在近年来的肿瘤治疗中取得了显著的疗效,被认为是最有前景的肿瘤治疗方式之一,但是,免疫疗法并不是对所有癌症都有效,因此需要根据患者的具体情况制定个性化的治疗方案,其高昂的成本也使许多患者望而却步,因此开发新的肿瘤治疗方法依然是十分重要的。
2023年10月25日,美国马萨诸塞大学医学院Dohoon Kim教授团队在国际顶级期刊Nature上发表了一篇题为Disruption of sugar nucleotide clearance is a therapeutic vulnerability of cancer cells的文章,该项研究报告了一项新的癌症治疗方法,即通过靶向肿瘤细胞代谢途径更有效的杀死癌细胞。

作者以一个通俗易懂的“废水池模型”来解释这项新的策略(图一),我们都知道肿瘤细胞与正常的细胞在代谢上有巨大的差异,由于肿瘤细胞具有更高的能量获取需求,因此其在葡萄糖消耗,氨基酸代谢等方面都会与正常细胞不同,但有一点癌细胞同样也无法逃避,正常细胞在代谢的过程中会产生有毒的代谢中间产物,癌细胞同样也会在某些酶代谢步骤产生毒性中间产物,而这往往需要第二种酶继续将毒性产物处理为无毒产物,而作者团队的策略就是:针对癌细胞中的代谢通路,通过阻断特定酶的作用,导致毒性代谢产物在细胞内大量积累。在这种情况下,这些毒性代谢产物的积累对癌细胞产生有害影响,最终导致癌细胞死亡。
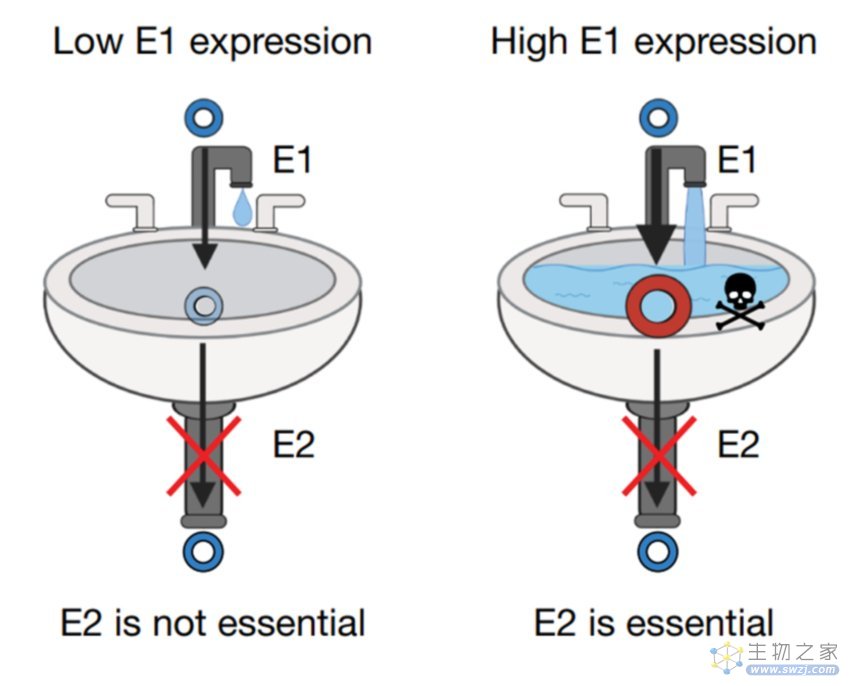
图一:kitchen-sink模型示意图1
那么现在的问题就是,如何找到这样的一个代谢通路?
DEPMAP数据库,这是一个包含了对多种癌症细胞系进行基因依赖性筛查数据的数据库。作者团队通过这个数据库进行了系统性的筛查,以确定特定代谢酶在癌细胞生存中的必需性。通过分析这些癌症细胞系的基因依赖性数据,寻找那些在某些癌症细胞系中必不可少,但在其他细胞系中却不是必需的代谢酶。这种不同的基因依赖性表现出这些细胞系之间对特定代谢酶不同的需求程度。通过这种方式,研究人员识别到了一种关键的糖核苷酸生物合成途径。
UGDH(UDP葡糖醛酸脱氢酶)是这一代谢途径中的一个关键酶,它负责将葡萄糖代谢产物转化为UDP葡糖醛酸(UDPGA),进一步,UXS1(UDP木糖合酶),作用于UDPGA,将其转化为UDP木糖。在这条通路中,高UGDH表达细胞中对UXS1酶的依赖性极高。作者同时还证明了阻断UXS1是通过累积中间产物UDPGA,而不是减少最终产物UDP-木糖的方式来使癌细胞受损的。
为了理解UXS1基因缺失后UDPGA在细胞中积累可能导致的毒性,研究团队通过基因集富集分析,观察了UXS1缺失后癌细胞的转录反应,结果表明, UXS1缺失导致多种高尔基体翻译后修饰基因和高尔基体运输相关基因的表达。整体来看,这种转录反应表明UXS1丧失和UDPGA积累的毒性特异性涉及到高尔基体。此外,UXS1的敲除还明显改变了高尔基体的形态(图三)。
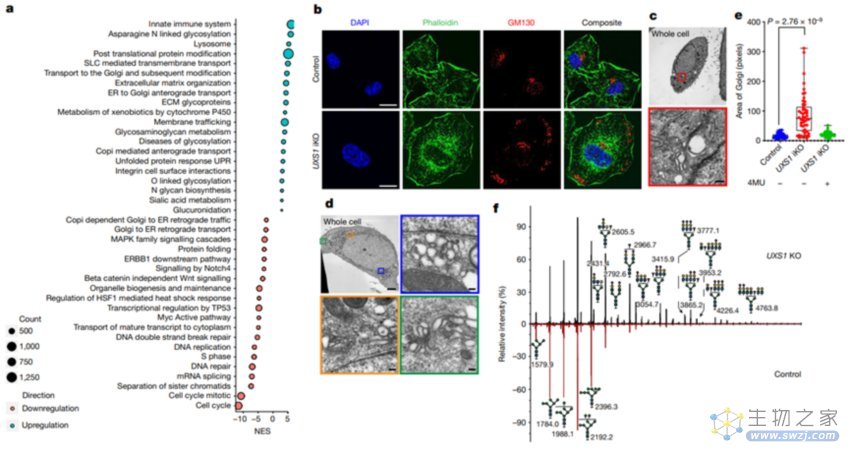
图二:UDPGA积累引起高尔基体功能障碍1
为了检测在体内环境中的肿瘤UXS1基因缺失的后果,团队进行了一系列的动物实验,结果表明在UGDH高表达的肿瘤中诱导UXS1基因缺失后,能显著抑制肿瘤生长并延长生存期。这表明针对UXS1的治疗在这类高UGDH状态的肿瘤中具有潜在的疗效。但在UGDH低表达的肿瘤中,UXS1基因缺失对肿瘤没有影响。这意味着治疗效果似乎更依赖于肿瘤的UGDH水平。总的来看,这些结果显示了对UXS1的治疗存在一定的治疗窗口和潜在的选择性。然而,需要进一步研究和评估在临床应用中的安全性和有效性。
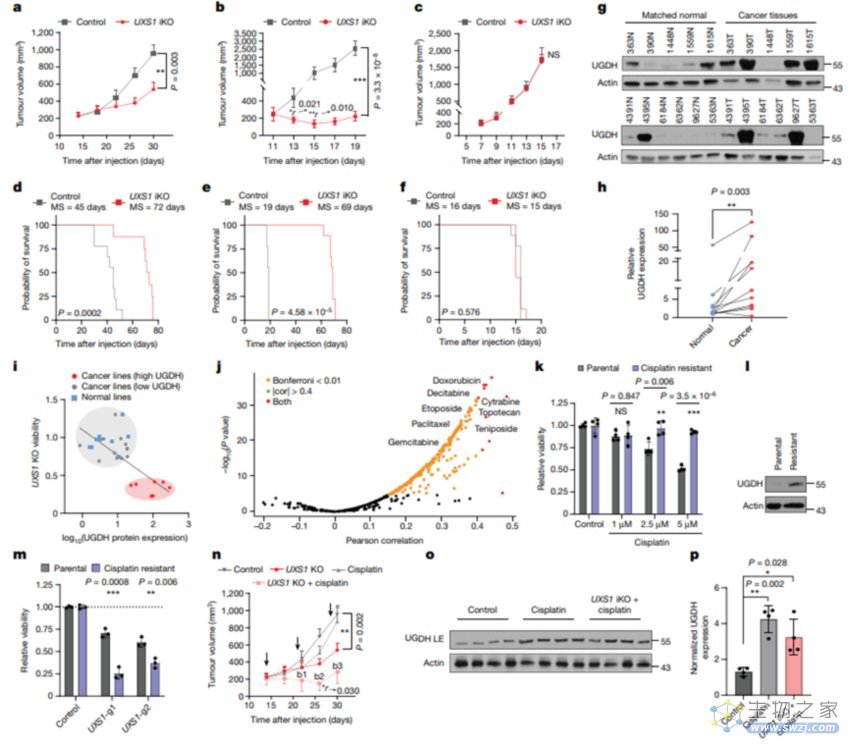
图三:UXS1是一种癌症选择性治疗靶点1
简而言之,这项研究探索了针对癌症治疗的新策略,以阻断UXS1基因来干扰UDP葡糖醛酸(UDPGA)的代谢。研究发现,UXS1缺失对于UGDH高表达的肿瘤有显著的治疗效果,能抑制肿瘤生长并延长生存期。这表明针对UXS1的治疗对于特定肿瘤类型可能具有潜在疗效。然而,在UGDH低表达的肿瘤中,UXS1基因缺失对肿瘤生长没有影响。这项研究强调了UXS1的潜在作为靶向治疗的重要性,但也指出了治疗效果在肿瘤类型和个体患者之间可能存在差异,需要进一步的研究来评估临床应用的安全性和有效性。
Reference:
1. Doshi, M.B., Lee, N., Tseyang, T. et al. Disruption of sugar nucleotide clearance is a therapeutic vulnerability of cancer cells. Nature (2023). https://doi.org/10.1038/s41586-023-06676-3































