胰腺癌是世界范围内最难治疗的恶性肿瘤之一,以其难治性和预后差而闻名。近几十年来,KRAS蛋白因其特殊的分子结构和生物学特性而一直保持着“不可用药”的声誉。幸运的是,近年来随着KRASG12C抑制剂的出现,KRAS形成的重重壁垒被打破。FDA已批准KRASG12C抑制剂sotorasib用于治疗KRASG12C驱动的癌症患者。与此同时,研究者们也密切关注其他KRAS突变抑制剂的开发。由于PDAC发病率高,开发KRASG12D/V抑制剂成为关注的焦点。本文将对PDAC的临床现状及靶向KRASG12D/V的研究进展展开讨论,并与大家一起见证其潜在的应用前景。
01
KRAS与PDAC
胰腺癌是一种发病率高、预后差的恶性肿瘤。肿瘤驱动基因在肿瘤的增殖和转移中起着重要作用。因此,针对肿瘤驱动基因的靶向治疗在PDAC的治疗中具有相当的前景。大多数pdac已被确定包含以下4种驱动突变:克尔斯滕大鼠肉瘤(KRAS)、细胞周期蛋白依赖性激酶抑制剂2 (CDKN2A)、肿瘤抑制蛋白53 (TP53)和小母亲抗Decapentaplegic同源物4 (SMAD4)。值得注意的是,PDAC中KRAS突变的发生率达到了惊人的86%。毫无疑问,靶向KRAS治疗将是改善PDAC不良预后的关键。
02
KRAS靶向药物的研究现状
由于其表面缺乏结合域、下游通路分支多而复杂等原因,KRAS靶向药物的设计长期处于停滞状态,直到2013年Shokat等人发现了KRASG12C突变(甘氨酸突变为半胱氨酸)的分子筛选方法。KRAS靶向药物开发刚刚进入快速发展状态。目前已有多项kras靶向药物及相关通路药物进入临床和临床前研究。遗憾的是,目前所有临床批准的KRAS抑制剂都靶向KRASG12C,而PDAC中KRASG12C突变的比例极低(约1%)。然而,由于KRAS突变亚型之间有许多相似的结构,因此有可能开发基于KRASG12C抑制剂的其他KRAS抑制剂。研究人员已经开发出一种名为MRTX1133的KRASG12D抑制剂,其分子结构基于MRTX849。MRTX1133在体外和体内模型中均取得了良好的效果。因此,由于耐药,泛kras抑制剂的开发正被广泛用于胰腺癌的治疗。
03
PDAC的临床治疗
针对可切除肿瘤的患者
目前,只要患者的肿瘤仍处于可切除期,手术切除仍是临床上PDAC的最佳治疗方法之一。除手术外,化疗药物辅助治疗也被证明对患者有益。对于可切除或可能切除的PDAC患者,然而,由于缺乏进一步证据证明辅助化疗的获益程度和对PDAC患者总生存期的影响,辅助化疗的使用仍需进一步探索。
适合不适合手术的病人
目前PDAC的筛查针对高危人群,由于该人群发病率相对较低,目前尚无针对普通人群的有效筛查。因此,一些患者在诊断PDAC时已经错过了可切除期。由于PDAC发生转移的时间较早,大多数患者在诊断时已为晚期肿瘤。对于局部晚期或远处转移的PDAC患者,全身化疗是目前有效的治疗方法。吉西他滨联合白蛋白结合型紫杉醇以及FOLFIRINOX是常用的化疗方案。虽然一小部分晚期PDAC患者在化疗后肿瘤会缩小到可手术的大小,但绝大多数患者将无法治愈。对于局部晚期或远处转移的PDAC患者,全身化疗的主要目的是延缓疾病进展和延长生命。
生物标志物靶向治疗是一种新的治疗模式,在PDAC的治疗中取得了一些进展。BRCA1和BRCA2基因突变在乳腺癌患者中常见,大约5%的胰腺癌患者也存在这些基因的突变。之前的试验已经表明,PARP抑制剂在涉及BRCA1或BRCA2突变的乳腺癌和卵巢癌患者中具有积极作用,在胰腺癌患者中也有类似的发现。3期POLO试验的结果表明,与安慰剂组相比,奥拉帕利延长了生殖细胞系BRCA突变的转移性胰腺癌患者的无进展生存期。2019年,FDA批准了PARP抑制剂奥拉帕利(olaparib)用于治疗生殖细胞系brca突变的转移性胰腺癌。
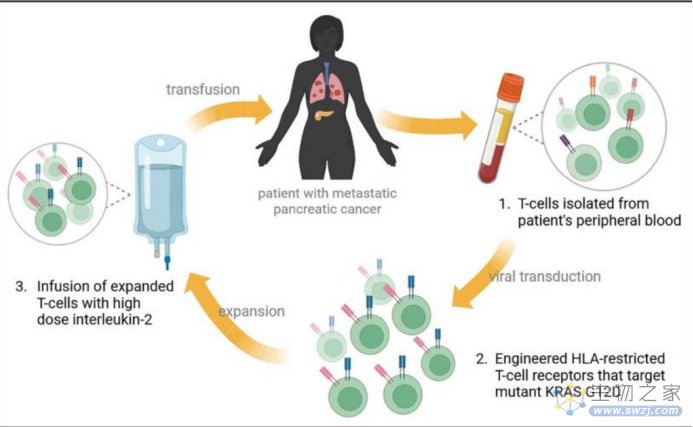
总体而言,尽管胰腺癌的临床疗法正在研究中,但进展相对有限。另一方面,新型治疗方法的研究,如靶向治疗和免疫治疗,有可能突破目前的治疗困境。KRAS是RAS基因家族的一员,长期以来一直被认为是不可用药的,近年来针对KRAS的靶向药物研究取得了巨大的突破,使NSCLC患者受益,这令人振奋。很明显,作为一种KRAS突变比例也很高的肿瘤,PDAC很可能从中获益。
04
PDAC中的KRAS突变
鼠肉瘤病毒(rat sarcoma virus, RAS)基因是恶性肿瘤中最常见的突变基因家族之一。RAS基因家族包括3个基因:KRAS、HRAS和NRAS。KRAS是RAS基因最常见的突变类型,占RAS基因相关恶性肿瘤的80%。KRAS基因使用不同的外显子4编码两个剪接变异体,产生KRAS4A和KRAS4B。实验证明这两种亚型与肿瘤形成相关。KRAS突变主要见于肺癌(32%)、PDAC(86%)和结肠癌(41%)。PDAC中最常见的KRAS亚型是KRASG12D(45%)和KRASG12V(35%)。
05
PDAC的KRAS抑制剂
KRASG12C抑制剂
KRASG12C抑制剂在非小细胞肺癌的治疗中显示出了优异的效果,对其对其他实体肿瘤疗效的研究仍在进展中。评估索托拉西布(AMG510)性能各方面的1期试验(NCT03600883)表明,索托拉西布对含有KRASG12C突变的实体瘤具有良好的抗肿瘤活性。另一种KRASG12C抑制剂MRTX849在小鼠异种移植模型中验证了其对含有KRASG12C突变的肿瘤的抗肿瘤活性。然而,FDA尚未批准任何KRASG12C抑制剂用于胰腺癌的治疗。虽然在某些地区,PDAC患者的KRASG12C突变频率异常高,如日本超过60%,但全球范围内PDAC患者的KRASG12C突变频率仍相当低,因此使用KRASG12C抑制剂临床治疗PDAC的前景有限。
KRASG12D抑制剂
MRTX1133
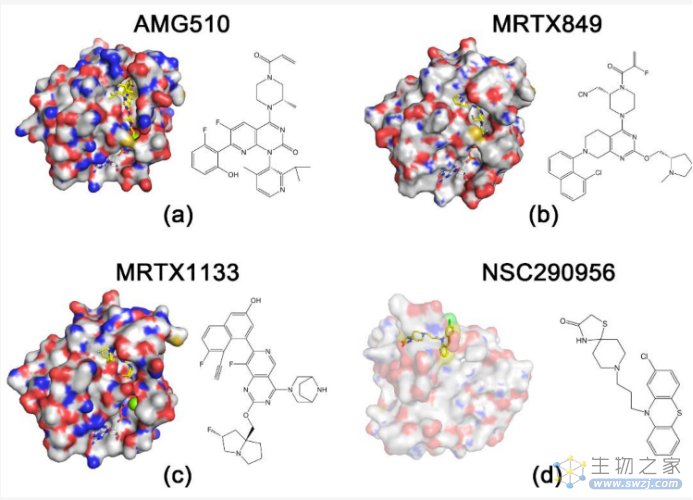
虽然sotorasib已被FDA批准用于治疗含KRASG12C突变的NSCLC,但其他KRAS突变抑制剂的开发已陷入停滞。KRASG12C突变的内在水解率约相当于野生型KRAS的70%,而KRASG12D突变的内在水解率仅低于30%。这一缺点给KRASG12D抑制剂的设计带来了挑战。2022年2月,Mirati Therapeutics宣布了一种选择性非共价抑制剂,即KRASG12D的MRTX1133。研究者在抑制剂和12-天冬氨酸之间引入了盐桥,这通过一系列修饰来增强抑制剂对KRASG12D的选择性,从而避免与野生型KRAS结合。这将为KRAS抑制剂的联合治疗研究提供新的思路。在之前的研究中,MRTX1133在胰腺癌小鼠异种移植模型中取得了优异的结果,与对照组相比,在3 mg/kg BID (IP)下,肿瘤体积减少了94%。
此外,不可逆的泛erbb抑制剂afatinib在体外与MRTX1133有效共作用,并且在体外对MRTX1133产生获得性耐药的癌细胞对这一联合治疗仍然敏感。最后,在原位PDAC小鼠模型中,MRTX1133和afatinib联合应用可使肿瘤消退并延长生存期。这些结果提示,对ERBB和KRAS信号通路的双重抑制可能具有协同作用,并避免了KRAS突变胰腺癌患者获得性耐药的快速发展。
肽核酸类(PNAs)
肽核酸(PNAs)是合成的核苷酸类似物,其分子结构与DNA和RNA非常相似。此外,PNAs具有稳定的化学结构,不易被核酸酶或蛋白酶降解。基于以上特点,PNAs治疗有很大潜力成为对抗恶性肿瘤的新工具。在最近的一项研究中,针对KRASG12D突变基因片段设计了几种PNAs,并在含有KRASG12D突变的人转移性胰腺癌细胞系AsPC-1中进行了测试。结果表明,PNAs显著抑制肿瘤细胞活性,降低KRASG12D突变基因的表达。PNAs在细胞水平成功抑制KRASG12D突变基因,为后续动物实验提供了可能性。
Pan-RAS抑制剂
与特异性抑制剂相比,泛ras抑制剂具有更广泛的适用性,可为不同类型KRAS突变患者提供治疗。此外,泛ras抑制剂可避免野生型KRAS代偿性激活导致的耐药。虽然这类抑制剂具有较高的毒性和脱靶抑制,但仍具有很大的研究潜力。一些泛RAS抑制剂已被证明对RAS突变有良好的特异性,动物模型也对这些抑制剂有相当程度的耐受。
06
结论与展望
胰腺癌以病死率高、生存期短而著称。尽管近年来在早期诊断、围手术期管理和系统治疗方面取得了一些进展,但患者预后并没有明显改善。作为最常见的胰腺癌类型,PDAC已成为临床和临床前研究的热点。由于KRAS是PDAC中最常见的致癌性突变之一,其抑制剂的问世为PDAC的临床治疗开辟了新的途径。然而,KRASG12C突变占PDAC KRAS突变的比例非常小,目前临床使用的KRASG12C抑制剂对PDAC患者的疗效非常有限。幸运的是,KRASG12D抑制剂已经开发出来并进入临床前试验,而KRASG12V抑制剂的探索也在进行中。相信在不久的将来,KRASG12D/V抑制剂将为PDAC的治疗提供新的视角。































