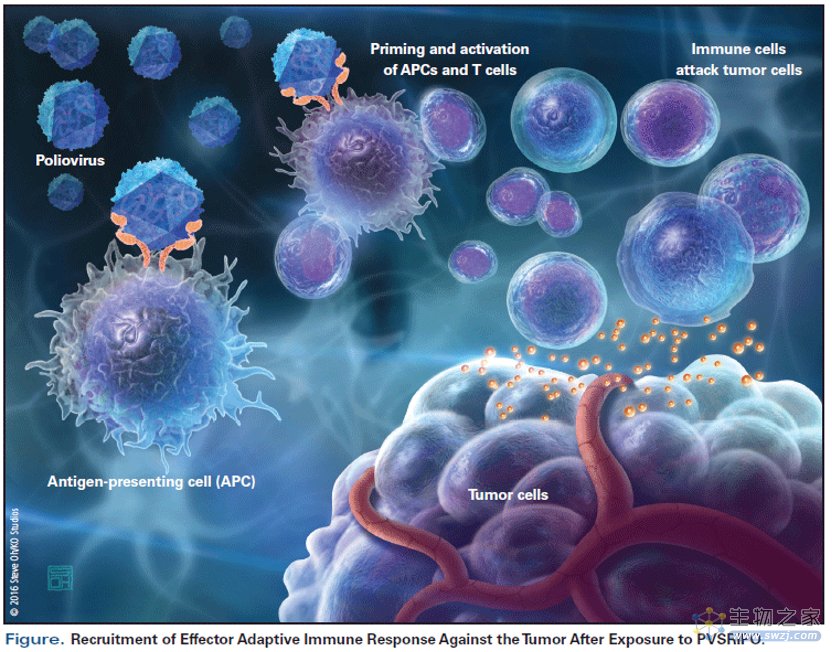
溶瘤病毒/oncolytic virus
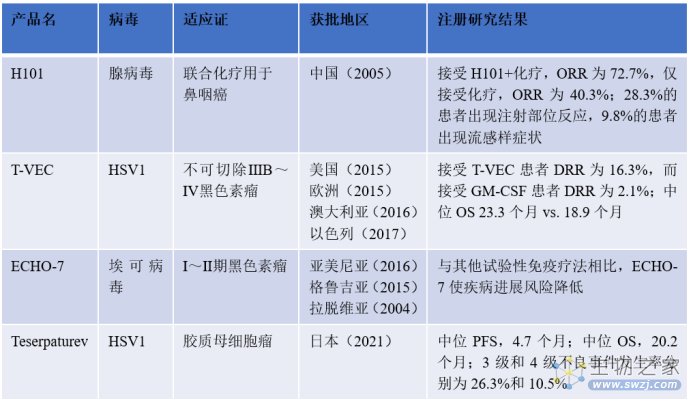
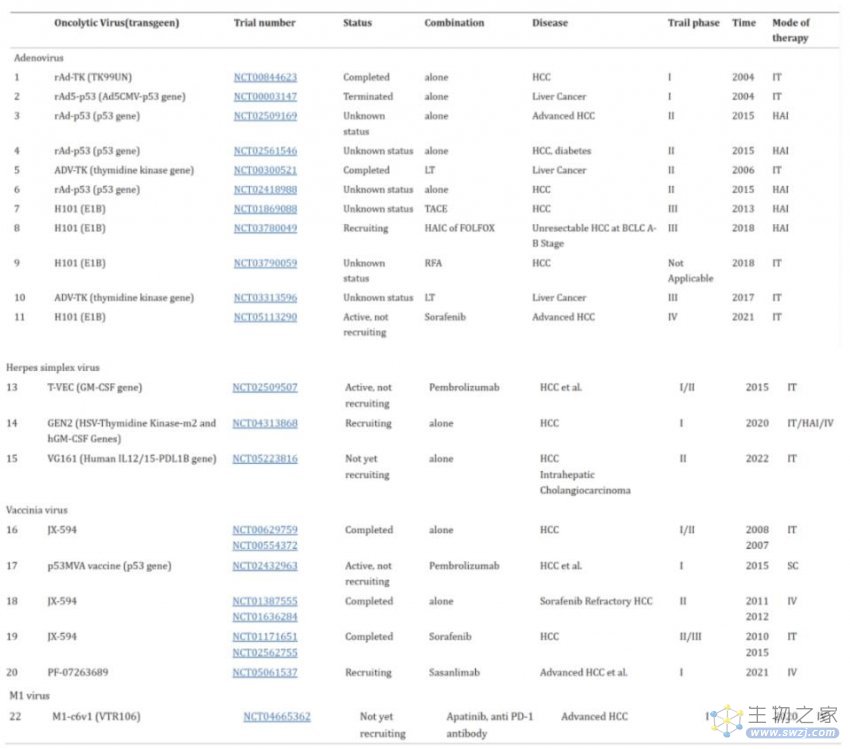
近日,复诺健生物宣布,其溶瘤病毒产品I类创新药VG161获FDA授予快速通道资格(FTD), 用于治疗经标准治疗失败的晚期肝细胞癌。溶瘤病毒(OV)是一种新兴的肿瘤免疫治疗方法,全球已有4款OV获批上市(表1)。
“以毒攻毒”?关于溶瘤病毒疗法
所谓溶瘤病毒,其实并不是特定的一种病毒,而是一类病毒,它们倾向于感染肿瘤细胞,大部分溶瘤病毒主要通过以下两种机制抗肿瘤:
(1)激发机体的免疫反应:通过抗原(病毒自身和肿瘤)激活机体的天然免疫和继发性免疫反应,杀死肿瘤;
(2)裂解肿瘤细胞:溶瘤病毒在肿瘤细胞里面能够大量繁殖,最终让肿瘤细胞裂解、破碎、死亡。需要说明的是,溶瘤病毒也会感染正常细胞,只是因为各种原因,它们对正常细胞毒性弱很多。
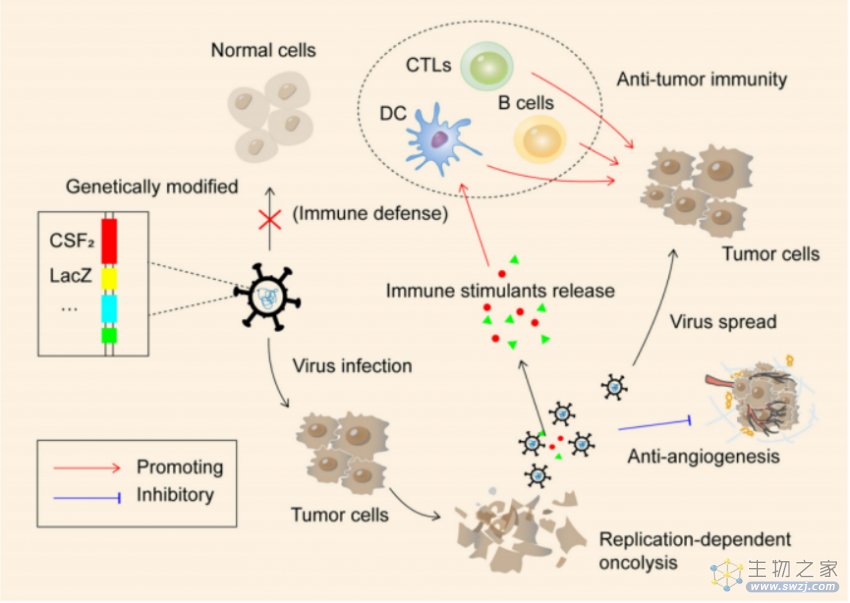
溶瘤病毒大致可以分为两类:一是在自然界里存在的,这一类不是特别的多;二是经过基因改编的病毒,对肿瘤细胞更加具有选择性,目前常见的溶瘤病毒均属于这一类。改造病毒包括腺病毒、牛痘病毒、疱疹病毒等。

1.黑色素瘤
2015年10月27日FDA批准T-VEC用于手术切除后复发的黑色素瘤的不可切除病灶的局部治疗之后,同年欧盟委员会也对T-VEC进行了批准:T-VEC可以用于治疗未转移至骨骼、脑部、肺部或其它脏器的不可切除的Ⅲb、Ⅲc、ⅣM1a期黑色素瘤。这两项批准均依据的是OPTiM研究的结果。
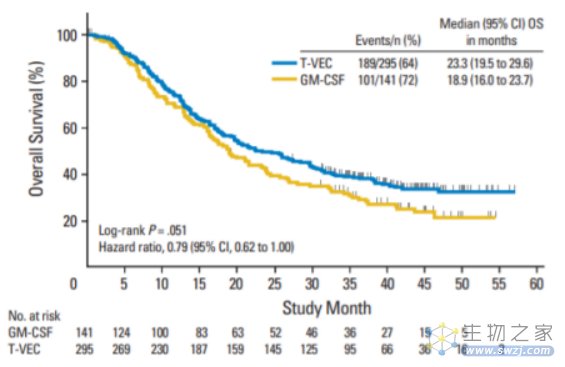
OPTiM研究入组了436位不可切除的Ⅲb/c期或Ⅳ期黑色素瘤患者,并按照2:1随机给予病灶内注射T-VEC(n=295)或皮下注射GM-CSF(n=141)。T-VEC的给药方式为初始≥4ml×106PFU/ml,三周后每两周一次≥4ml×108PFU/ml。GM-CSF的给药方式为在28天一个周期中,前14天每天给药125μg/m2。
结果显示,两组DRR为16.3% vs. 2.1%。客观缓解率为26.4% vs. 5.7%,完全缓解率为11% vs 1%。
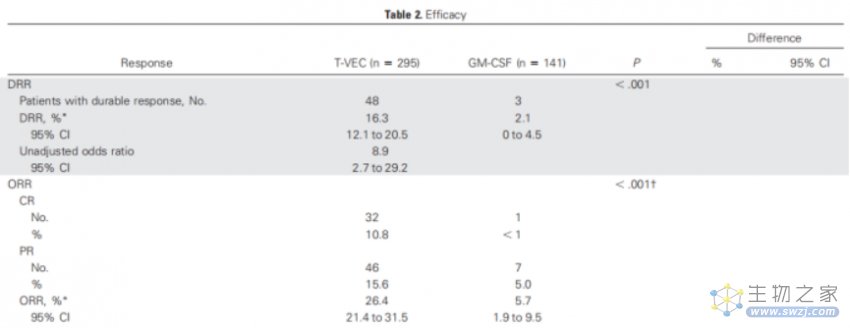
中位OS为23.3个月 vs 18.9个月(HR=0.67,P<0.05)。
2.非小细胞肺癌
Cancer 杂志上曾发表关于联合溶瘤病毒与化疗治疗 KRAS 通路激活的转移或复发型非小细胞肺癌(NSCLC)的研究。
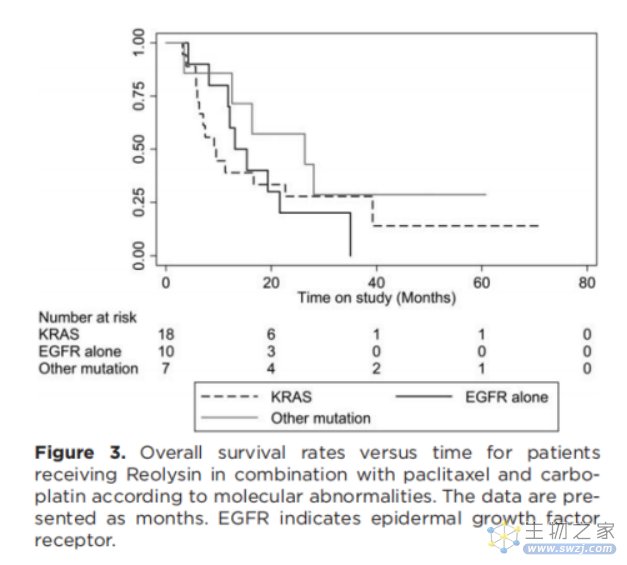
研究纳入 37 例患者晚期NSCLC。大多数为腺癌(n = 27),14 例 KRAS 突变,10 例 EGFR 扩增,1 例 EGFR 突变,6 例兼有 KRAS 突变和 EGFR 扩增,2 例兼有 EGFR 突变和 EGFR 扩增,4 例兼有 BRAF 突变和 EGFR 扩增。患者采用溶瘤病毒Reolysin+化疗治疗。
联用 Reolysin 和化疗的 RECIST 应答率(31%)较单独化疗(20%)显著升高。Reolysin 联合紫杉醇和卡波铂治疗耐受性良好且能有效控制病情。24 例患者接受了治疗前及治疗 2 个循环后的 PET-CT 评估,其中 10 例患者 PET 标准摄取值(SUV)下降超过 40%,包括 6 例 PR 和 4 例 SD 患者。RECIST+PET ORR 为 43%。
10 例患者在 4-6 个循环联合治疗后接受 Reolysin 单独维持治疗,3 例单用 Reolysin 维持的患者则改为联合治疗。7 例患者在平均 34.2月(26.9-71.5 )的随访期后仍然生存,其中 2 例没有病情进展。
3.恶性胶质瘤(MG)
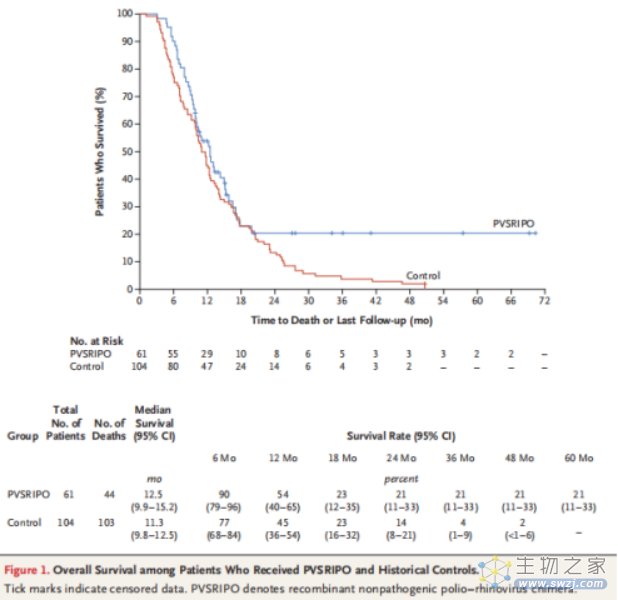
2018年6月28日,顶尖医学期刊NEJM上公布了重磅数据。这款PVSRIPO溶瘤病毒疗法的潜力在于:2年生存率为21%,已经比历史数据(14%)高出50%;3年生存率同样为21%,历史数据仅为4%,足足高出5倍之多。
截至2019年9月2日,5例患者接受了第二次肿瘤内输注PVSRIPO,其中1例共接受3剂。两次输注PVSRIPO的患者分别在第一次输注后72、43、34和6个月后进行了治疗。另一名患者在第一次输注60个月后接受第二次PVSRIPO输注,第一次输注78个月后接受第三次PVSRIPO输注。全部患者在影像学上均表现肥皂泡样,2例患者表现为肿瘤收缩。再治疗后未发现与PVSRIPO相关的3级以上不良事件。其中3例患者在第一次PVSRIPO输注后存活81个月、80个月和52个月以上,即第二次输注后分别存活9个月、20个月和18个月以上。2例患者分别在首次输注PVSRIPO 63个月和20个月后死亡,即第二次输注PVSRIPO 19.6个月和14个月后死亡。
4.溶瘤病毒治疗TNBC 89%患者2年内无复发
三阴性乳腺癌(TNBC)约占所有乳腺癌病例的15%,顾名思义,TNBC患者缺乏雌激素受体(ER)和孕激素受体(PR)表达,缺乏治疗靶点,因此患者预后较差,名副其实的“最恶”乳腺癌。
早期三阴性乳腺癌的标准疗法是化疗,近年来免疫疗法,如PD-(L)1抑制剂等,进展让人寄予厚望,但离攻克TNBC仍任重道远。
发表在《自然》子刊Nature Medicine的一项溶瘤病毒2期临床试验结果显示,手术前接受溶瘤病毒与化疗的组合治疗后,更多TNBC患者手术切除组织中的癌细胞消失,且近90%患者在手术进行后的两年没有疾病复发!

talimogene laherparepvec(T-VEC)于2015年获批用于治疗晚期黑色素瘤。
既往试验发现,当TNBC患者肿瘤内含有较多浸润的淋巴细胞时,患者对于化疗作为新辅助疗法的应答性较好。由于溶瘤病毒具有募集免疫细胞至肿瘤的能力,因此研究人员便思考是否化疗与溶瘤病毒疗法组合可以改善TNBC患者的治疗。
这项试验中最终纳入37位II、III期的TNBC患者,在接受手术移除肿瘤之前,他们皆进行长达12周的化疗,并在同时接受了数次T-VEC病毒注射至其肿瘤内。研究人员在第6周时采集病患肿瘤活检组织并在手术后取下其肿瘤进行分析。所有患者在手术完成后持续接受标准疗法治疗。
当研究人员对活检组织进行分析时发现,有许多杀伤T细胞浸润至肿瘤内,这是T-VEC病毒作用的标志。此外,有45.9%接受T-VEC与化疗组合疗法的患者在完成治疗时,其肿瘤中没有发现活的癌细胞。这项数值在过去仅接受化疗的患者身上仅约15-30%。而有达89%接受组合疗法的患者,在两年后没有疾病复发。而以往仅接受化疗新辅助治疗的患者这一数值只有60%。现今TNBC的标准疗法是化疗与PD-1抑制剂帕博利珠单抗(K药)构成的组合疗法,接受此疗法TNBC患者的三年无复发率约为84%。
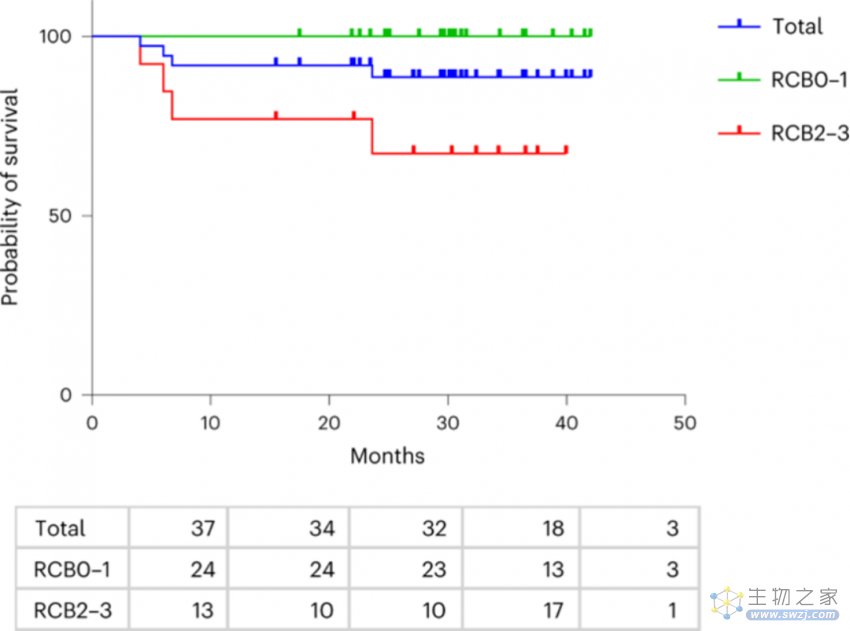
换言之,如果试验中患者的无复发率能够维持的话,这项溶瘤病毒组合疗法将可媲美现今的帕博利珠单抗标准疗法!
5.溶瘤病毒联合PD-(L)1治疗胰腺癌
1/2期GOBLET研究的晚期/转移性胰腺导管腺癌(PDAC)一线队列的中期结果。数据表明,在晚期/转移性胰腺导管腺癌中,pelareorep(一种新开发的溶瘤病毒)与PD-(L)1抑制剂和标准化疗具有协同作用。Pelareorep联合治疗具有70%的客观缓解率(ORR;n=10),几乎是历史对照试验中报告的平均ORR(25%)的三倍!

晚期胰腺癌的一种新的选择是溶瘤病毒免疫疗法,它使用野生型或基因修饰的病毒选择性地杀死肿瘤细胞,并促进针对肿瘤的固有和适应性免疫应答。溶瘤呼肠孤病毒pelareorep是呼肠孤病毒3型Dearing株的专利分离物。癌细胞中病毒的选择性复制和溶解受到多种因素的影响,包括RAS和PKR信号通路的上游和下游介质。临床前和临床研究表明,几种化疗药物(包括紫杉烷类、吉西他滨和伊立替康)联合治疗可增强pelareorep的复制和溶解。
溶瘤腺病毒已被开发并在临床前胰腺模型中进行了研究。GOBLET PDAC队列评估了pelareorep联合罗氏抗pd - l1检查点抑制剂阿替利珠单抗以及化疗药物吉西他滨和白蛋白结合型紫杉醇,该队列中10例可评估患者中有7例达到了部分缓解(截至截止日期,3例已确认,4例未确认)。另外2例患者达到疾病稳定,ORR和临床获益率分别为70%和90%。本研究未观察到联合用药的安全性信号。既往在SITC摘要中报告的ORR是吉西他滨联合白蛋白结合型紫杉醇历史对照试验中平均ORR(仅为25%)的近三倍。
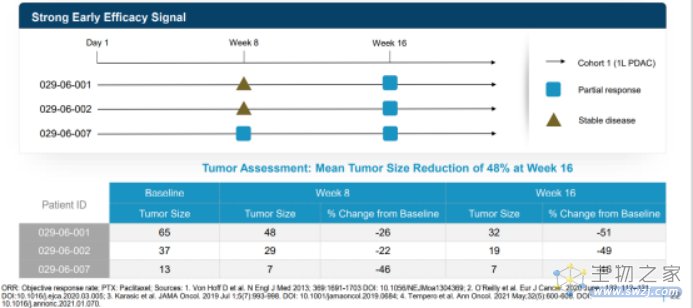
此外,PD-(L)1抑制剂仅对低于1%的高微卫星不稳定的胰腺癌患者有益。因此,GOBLET的中期结果强烈提示,当与检查点抑制和化疗联合使用时,pelareorep逆转具有免疫抑制作用的肿瘤微环境的能力产生了协同作用,从而大大改善了应答。
GOBLET的中期结果代表了一个关键的临床里程碑,为难以治疗的适应症提供了强有力的概念验证。除了这个潜在的PDAC机会外,溶瘤剂继续推进pelareorep在转移性乳腺癌中的注册研究。该公司针对 HR+/HER2- 转移性乳腺癌 BRACELET-1 的随机 2 期试验仍有望在 2023 年上半年得出总体缓解率、无进展生存期和不断发展的总生存期数据。
6.肝细胞癌OV的临床试验
当前,癌症患者中有13个OV用于临床试验。然而,只有少数临床试验报告了结果。腺病毒dl1520的临床试验结果显示,HCC患者虽然表现出耐受性,但并未从治疗中获益。JX-594对肝癌患者具有抗肿瘤、抗血管、免疫治疗作用和良好的耐受性。在2005年的一项I期临床研究中,研究人员确定1×109pfu是原发性或转移性癌症患者IT注射的最大耐受剂量。这项研究还表明,JX-594可以诱导抗血管细胞因子并抑制HBV感染。一项II期临床试验表明,患者的中位总生存时间与病毒剂量显著相关,高剂量组的OS比低剂量组长7.4个月,这主要是由于JX-594诱导体液和细胞抗肿瘤免疫的原因。此外,OVs引起的肿瘤血管减少和坏死也是患者生存的重要原因。
7.溶瘤病毒治疗卵巢癌
VIRO-15研究纳入标准的患者包括原发性或获得性铂耐药或铂难治性卵巢癌(PRROC),共纳入27例患者,其中铂耐药组14例,铂难治组13例。年龄35 ~ 78岁,中位年龄62岁。既往治疗线数的中位数(范围)为4(2 ~ 9)。所有患者均完成Olvi-Vec输注和化疗。
中位随访时间为47.0个月(95% CI, 35.9个月至NA)。ORR为54% (95% CI, 33% ~ 74%), DOR为7.6个月(95% CI, 3.7 ~ 9.6个月)。DCR为88%(21/24)。中位PFS为11.0个月(95% CI, 6.7 ~ 13.0个月),6个月PFS率为77%。铂类耐药组和铂类难治组的中位PFS分别为10.0个月(95% CI, 6.4 ~ na个月)和11.4个月(95% CI, 4.3 ~ 13.2个月)。全组患者的中位OS为15.7个月(95% CI, 12.3 ~ 23.8个月)。铂耐药组和铂难治组的中位OS分别为18.5个月(95% CI, 11.3 ~ 23.8个月)和14.7个月(95% CI, 10.8 ~ 33.6个月)。
在这项2期非随机临床试验中,在PRROC患者中,Olvi-Vec序贯铂类化疗(联用或不联用贝伐珠单抗)作为免疫化疗显示出有前景的ORR和PFS,且安全性可控。这些产生假设的结果有必要在确证性3期试验中进行进一步评估。
随着100多年的发展,OVT已成为治疗癌症的高效方法。OVs可以特异性感染并杀死肿瘤细胞,重塑免疫抑制性,并刺激全身性抗肿瘤反应。溶瘤病毒单独、联合化疗、PD1/L1和CAR-T在临床上取得非常可观的效果,相信随着医学的发展,溶瘤病毒会成为肿瘤治疗甚至是治愈的新希望!































