迁移体是最近发现的细胞器,它形成于迁移细胞后缘的收缩纤维的末端或分支点上。整合素在迁移体形成部位的募集对迁移体的生物发生至关重要,但整合素如何靶向迁移体形成位点目前尚不清楚。
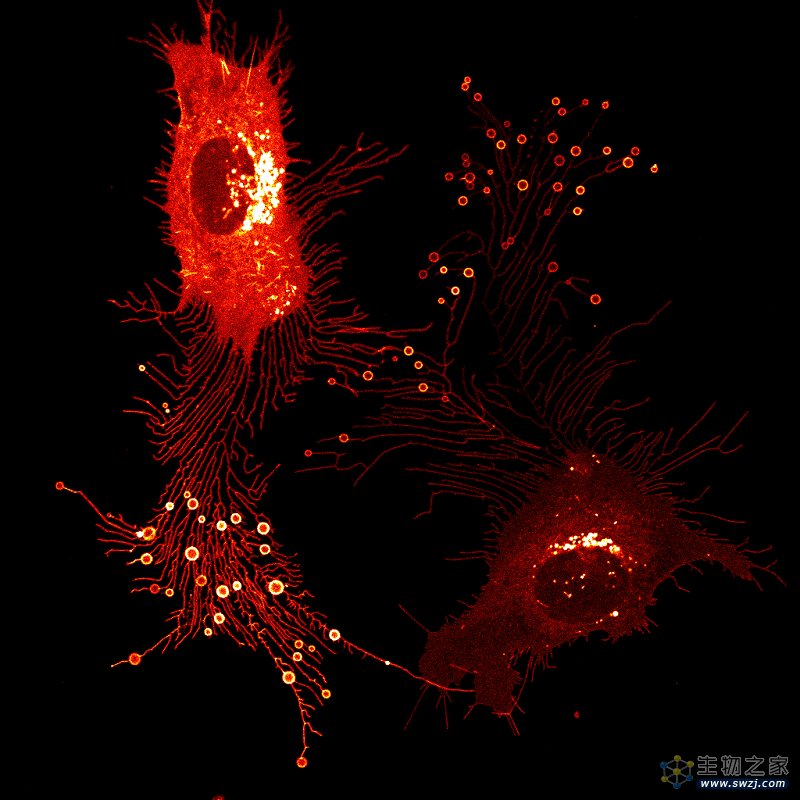
2023年5月4日,清华大学俞立团队在Cell Research 在线发表了题为“The phosphatidylinositol (4,5)-bisphosphate-Rab35 axis regulates migrasome formation”的研究论文,该研究发现在迁移体形成之前,PIP5K1A,一种将PI4P转化为PI(4,5)P2的PI4P激酶,被募集到迁移体形成位点。PIP5K1A的募集导致在迁移体形成位点产生PI(4,5)P2。
一旦积累,PI(4,5)P2通过与Rab35的c端多碱性簇相互作用将Rab35招募到迁移体形成位点。该研究进一步证明,活性Rab35通过在迁移体形成位点募集和聚集整合素α5来促进迁移体的形成,这可能是由整合素α5和Rab35之间的相互作用介导的。该项研究确定了协调迁移体生物发生的上游信号事件。
另外,2022年11月28日,清华大学俞立团队在Nature Cell Biology (IF=29)在线发表题为“Monocytes deposit migrasomes to promote embryonic angiogenesis”的研究论文,该研究表明单核细胞沉积迁移体能够促进胚胎血管生成。总之,单核细胞沉积富含促血管生成因子的迁移体,促进血管生成(点击阅读)。
2022年6月2日,清华大学俞立团队在Nature Cell Biology (IF=29)在线发表题为“Assembly of Tetraspanin-enriched macrodomains contains membrane damage to facilitate repair”的研究论文,该研究发现在膜损伤后不久,富含 Tetraspanin 的宏结构域在损伤部位周围组装。 该研究表明富含 Tetraspanin 的宏结构域的组装会形成一个物理屏障来抑制膜损伤(点击阅读)。
2022年5月4日,清华大学俞立团队在Cell Research 在线发表题为“Retractosomes: small extracellular vesicles generated from broken-off retraction fibers”的研究论文,该研究描述了Retractosomes(收缩丝体)(当 RF 破裂时,它们会形成一种以前未报道过的细胞外囊泡;这些囊泡比迁移体小得多,大小从 50 nm 到 250 nm 不等;与迁移体类似,这些小的细胞外囊泡是迁移依赖性的) 的发现,这是一种由断裂的RF 产生的小细胞外囊泡。收缩丝体的生理功能仍有待确定。
2021年5月27日,清华大学俞立团队在Cell 在线发表题为“Mitocytosis, a migrasome-mediated mitochondrial quality-control process”的研究论文,该研究报道了Mitocytosis(线粒体胞吐),这是一种由粒体介导的线粒体质量控制过程。总之,线粒体胞吐是细胞迁移过程中重要的线粒体质量控制过程,它将线粒体稳态与细胞迁移耦合在一起。
2021年5月25日,清华大学戴琼海,俞立及范静涛共同通讯在Cell 在线发表题为”Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale“的研究论文,该研究提出了一种计算成像框架,称为数字自适应光学扫描光场相互迭代层析成像(DAOSLIMIT),它具有高速,高分辨率3D成像,平铺波前校正和紧凑型系统的低光毒性。通过同时对整个体积进行层析成像,该研究获得了在225×225×16μm3范围内的体积成像,在数十万个时间点上,毫秒级的横向分辨率高达220 nm,轴向分辨率高达400 nm。为了建立功能,该研究探索了中性粒细胞迁移和肿瘤细胞循环过程中不同物种的大规模细胞迁移和神经活动,并观察了哺乳动物的各种亚细胞动力学(点击阅读)。

迁移体是在迁移细胞后缘的收缩纤维上形成的囊状细胞器。迁移体具有重要的生理功能,包括器官形态发生、线粒体质量控制和细胞间蛋白质和mRNA的横向转移。在迁移体形成过程中,整合蛋白首先被靶向到回缩纤维的末端或分支点,形成整合蛋白灶。一旦整合蛋白灶形成,富含四联蛋白的微结构域开始在迁移体形成部位聚集,并最终扩展到迁移体。整合素如何靶向迁移体形成位点目前尚不清楚。
细胞器生物发生是一个高度协调的过程。磷酸肌苷是脂质信号分子,在细胞器生物发生中起着重要作用。例如,在自噬体形成过程中,磷脂酰肌醇3-单磷酸(PI3P)富集结构(称为omegasomes)首先在内质网(ER)上形成,然后作为一个平台招募自噬体形成所必需的蛋白质。目前尚不清楚迁移体的形成是否涉及信号通路的调控过程。
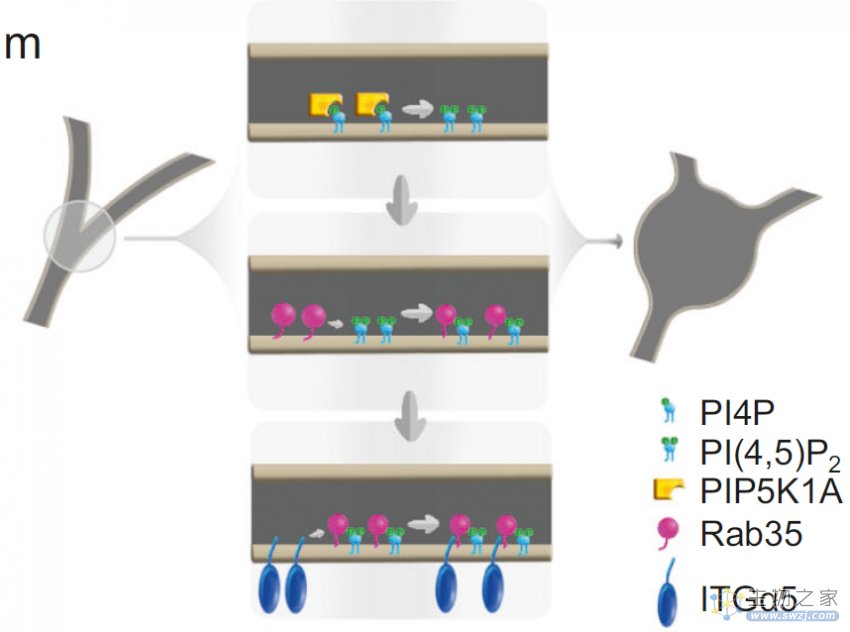
文章模式图(图源自Cell Research )
磷脂酰肌醇(4,5)-二磷酸(PI(4,5)P2)是一种多功能脂质,可调节大量亚细胞过程。PI(4,5)P2是最丰富的磷酸肌肽,主要存在于质膜中。通常认为,细胞PI(4,5)P2大部分是由磷脂酰肌醇4-单磷酸5激酶(PIP5Ks)合成的,它将磷脂酰肌醇4-单磷酸(PI4P)转化为PI(4,5)P2。在许多情况下,PI(4,5)P2通过与其伴侣蛋白的相互作用来实现其功能。到目前为止,已经确定了多个PI(4,5)P2相互作用域,包括PH, ANTH, ENTH和FERM。
该研究证明了迁移体的生物发生是一个高度调控的过程,其中PI(4,5)P2信号通路起着核心作用。该研究发现,在迁移体形成之前,PIP5K1A在迁移体形成位点重新合成PI(4,5)P2,当PI(4,5)P2的产生被抑制时,迁移体的形成被阻断。该研究发现Rab35是一个迁移体定位的PI(4,5) p2结合蛋白。进一步的研究表明Rab35对迁移体的形成至关重要。从机制上讲,Rab35通过与PI(4,5)P2的相互作用被招募到迁移体形成位点。随后,通过Rab35 -整合素α5相互作用,Rab35将整合素α5招募到迁移体形成位点,为四联蛋白依赖性扩增位点做好准备。
原文链接:https://www.nature.com/articles/s41422-023-00811-5































