新抗原的免疫疗法仅在少数有据可查的患者反应中显示出客观疗效。仍需要进行多种改进来改善其疗效,包括提高新抗原预测的准确性,克服免疫逃避,优化生产过程和有效招募患者。
新抗原(Neoantigens)是肿瘤细胞因各种肿瘤特异性改变而产生的新形成的抗原,如基因组突变、RNA剪接失调、翻译后修饰紊乱和整合的病毒开放读码框架等。新抗原被认为是非自我的,并引发不受中枢和外周耐受影响的免疫反应。
随着二代测序和生物信息学技术的发展,肿瘤特异性新抗原的快速鉴定和预测成为可能。与肿瘤相关抗原相比,具有高度免疫原性和肿瘤特异性的新抗原为肿瘤的个体化免疫治疗提供了新的靶点,并可作为肿瘤生存预后和免疫检查点阻断反应的前瞻性预测指标。理解新抗原诱导的抗肿瘤免疫应答机制以及简化基于新抗原的免疫治疗过程将有助于肿瘤治疗的发展。
近日,深圳大学医学部付利教授、四川大学华西医院黄灿华教授等在 Signal Transduction and Targeted Therapy 期刊发表了题为:Neoantigens: promising targets for cancer therapy 的综述论文。该综述介绍了新抗原的鉴定和表征,并概述了基于新抗原的前瞻性免疫治疗策略的现状、固有挑战和临床转化潜力。

01
什么是新抗原
新抗原是肿瘤细胞因基因组突变而产生的自身抗原。此外,在非病毒相关恶性肿瘤中,由于RNA剪接失调和翻译后蛋白修饰紊乱而产生的独特蛋白或肽也可产生新抗原。对于有病毒感染的癌症,如HPV阳性宫颈癌和EBV相关鼻咽癌,也可以通过病毒编码的开放阅读框(ORF)产生新抗原。与其他类型的肿瘤抗原(如癌睾丸抗原CTA和肿瘤相关抗原TAAs)相比,新抗原具有独特的肿瘤特异性和在正常组织中缺失的明显优势,为肿瘤的有效个性化治疗提供了理想的靶点。
由于通过体细胞肿瘤突变获得的新抗原具有高抗原性,针对新抗原的特异性T细胞可以绕过胸腺中的负向选择效应,增强了肿瘤特异性免疫应答。此外,免疫疗法增强的新抗原特异性T细胞应答具有持久和产生治疗后免疫记忆的能力,这为长期预防疾病复发带来了希望。
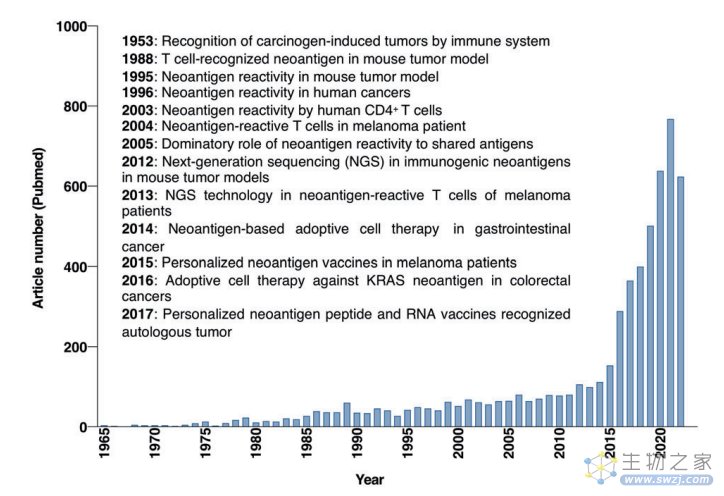
图1:肿瘤特异性新抗原的研究历程
02
免疫原性新抗原的鉴定、预测和验证
体细胞突变的鉴定
通过NGS比较肿瘤和正常组织之间的基因变化,大大加快了免疫基因组策略的制定。目前,从NGS数据中检测可能的新抗原的初始阶段是使用肿瘤和正常DNA的WES绘制肿瘤特异性的遗传异常。RNA-seq数据可以结合WES来确定突变基因是否在肿瘤中表达。
此外,在RNA-seq中还可以发现更多隐藏的生物信息,如拷贝数变化、微生物污染、可转座元件、细胞类型以及新抗原的存在等信息。RNA-seq也可用于检测可变剪接事件,并估计突变等位基因表达的相对频率。通过使用像配对测序这样可以检测染色体重排的方法,基于NGS的TMB检测的预测值可能会大大提高。为了完全识别移码突变和异常亚型引起的新抗原,需要使用Oxford Nanopore Technologies的纳米孔型测序仪MinION进行全长转录组测序,这一技术的准确率约为90%,为目前的RNA-seq提供了识别等位基因特异性转录和剪接的补充信息。免疫肽组学技术使附着在MHC上的肽的高通量鉴定成为可能,该技术使用MS直接检查免疫沉淀和提取的MHC结合肽。除了验证异常DNA序列或RNA表达产生的新抗原外,基于MS的蛋白质组学还为蛋白质水平的新抗原检测提供了“金标准”。此外,MS还与NGS整合,以进一步检测由体细胞突变,非编码RNA和蛋白酶体剪接产生的肿瘤特异性新抗原
计算机预测新抗原
基于NGS数据,可以利用计算机模拟方法创建虚拟多肽,并发现潜在的新抗原。简而言之,新抗原预测的工作流程可归纳为以下步骤:1)突变识别;2)HLA分型;3)基于HLA结合亲和力的新抗原筛选和优先排序;4)使用基于T细胞的检测方法对免疫原性新抗原进行实验验证。
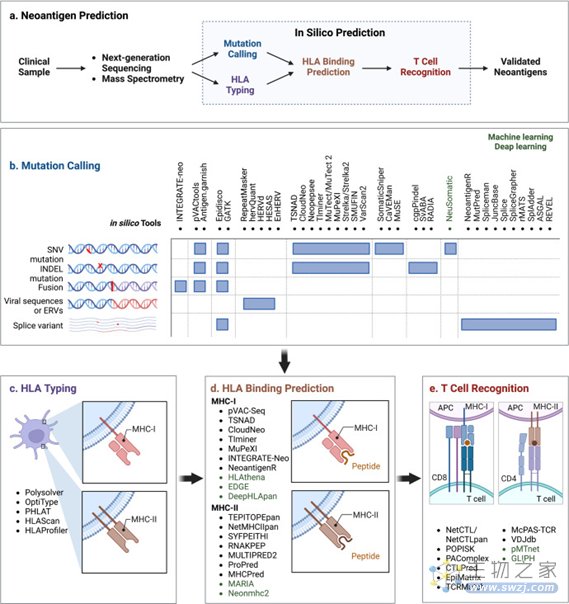
图2:新抗原预测的工作流程
候选新抗原免疫原性的评估和验证
在评估潜在新抗原的免疫原性时,考虑pMHC复合物的TCR识别至关重要。计算机技术中预测新抗原特异性T细胞识别最常用的方法是NetCTL / NetCTLpan,它通过结合MHC结合,C端切割亲和力和TAP转运来生成复合评分,而不是直接预测T细胞结合。除了鉴定TCR-pMHC配对外,聚类方法(如pMTnet和GLIPH)还可以聚类识别相同表位并预测其HLA限制的TCR。
新抗原对T细胞的反应性主要通过基于T细胞的检测、多色标记的MHC四聚体、酶联免疫吸附斑点(ELISpot)和T细胞谱分析进行验证或筛选。T细胞免疫原性检测是评价候选新抗原免疫原性最直接的方法。肽刺激后,通过流式细胞术测量 T 细胞活化标志物 4-1BB 和 OX-40 以及 ELISpot 测定中的 IFN 产生来测量体外扩增的新抗原特异性 T 细胞反应性。多色标记的MHC四聚体是利用DNA条形码、镧系元素编码或肽的荧光色素编码,评估T细胞对多种潜在表位的反应性,具有高度敏感且所需材料最少的优势;将单细胞RNA测序(scRNA-seq)与TCR测序相结合可以提高检测的灵敏度;基于WES指导的新抗原预测和短期肽刺激的T细胞培养物的TCR测序,特异性T细胞突变相关新抗原功能扩增(MANAFEST)试验可灵敏地表征新抗原特异性TCR Vβ克隆型。MANAFEST检测与所有HLA单倍型兼容,并可追踪福尔马林固定石蜡包埋(FFPE)和/或冷冻组织中的新抗原特异性T细胞。除了评估TCR Vβ克隆型的肿瘤特异性外,MANAFEST还可以研究新抗原特异性T细胞应答随时间推移的动态变化,并利用治疗前或治疗后获得的液体活检监测免疫治疗的疗效。此外还有Trogocytososis、T-Scan等新开发的方法用于新抗原的免疫原性。
03
基于新抗原的治疗策略
基于其肿瘤特异性和免疫遗传学的优势,新抗原可以作为癌症免疫疗法的新兴靶标,包括肿瘤疫苗、青蒿素综合疗法和基于抗体的疗法,以及免疫检查点阻断疗法的潜在预测因子。新抗原由专门针对每个患者发现的个体化新抗原或在许多患者癌症中表达的共享新抗原组成。由于个性化新抗原是患者特异性的,因此不能用于靶向大量患者。与个体化新抗原疗法相比,基于共享新抗原的现成疗法可以节约资源和时间。
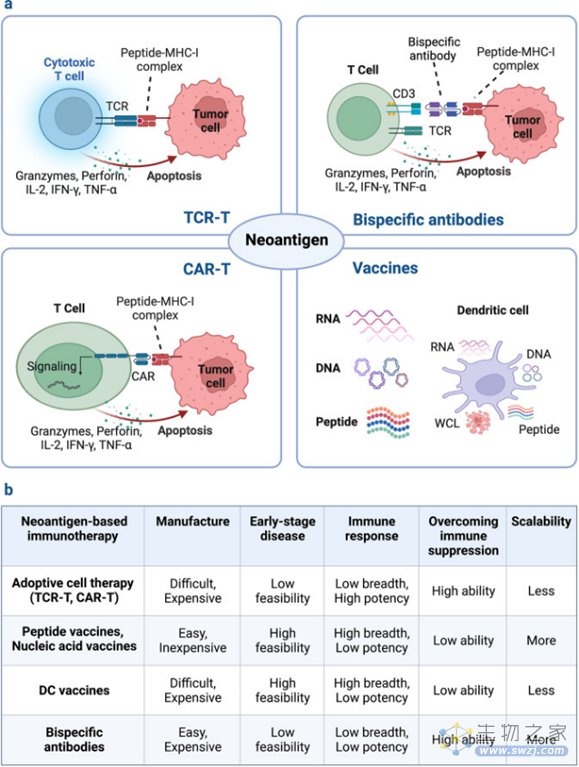
图3:基于新抗原的疗法的分类
基于新抗原的治疗性疫苗
新抗原疫苗是激发、增强和多样化抗肿瘤T细胞应答的有效手段,具有可行性高、总体安全性高、制备简单等优点。以新抗原为基础的多肽、核酸、树突状细胞等多种形式的疫苗正在不同类型肿瘤患者的临床试验中进行评估。目前多肽和核酸疫苗主要靶向来自体细胞突变的预测新抗原,包括SNVs、移码INDELs和基因融合。DC疫苗既可以通过脉冲合成肽或核酸靶向选定的新抗原,也可以通过引入全细胞裂解物(WCL)靶向整个TSA。
基于新抗原的过继细胞疗法
包括TIL和具有新型TCR或CAR的基因工程免疫细胞,目前已成功用于治疗多种恶性肿瘤。研究表明,在没有遗传修饰的情况下,体外扩增的自体TIL的过继转移可以诱导某些人类癌症的完全缓解。这些TIL取自患者,在特定情况下扩增,并增加其抗癌活性。然后,将该细胞产物重新输注回同一患者体内,该患者先前接受过非清髓性淋巴细胞耗竭化疗和细胞因子治疗,进而刺激有效的抗肿瘤免疫反应。TIL已被用于治疗对当前疗法(包括化学疗法,放疗和抗PD-1疗法)无效的转移性恶性肿瘤患者。
T细胞, NK细胞和巨噬细胞等免疫细胞可以在体外进行基因改造,以产生TCR和CAR,将其特异性重定向为新抗原。这些工程免疫细胞规避了诸如肿瘤抗原反应性TIL比例有限等问题。实体瘤中基于新抗原的CAR-T疗法最著名的例子是来自EGFRvIII突变的新抗原,EGFRvIII突变是由30%的胶质母细胞瘤患者自发的细胞外结构域片段框内缺失引起,这使其成为CAR-T疗法的理想靶点。人EGFRvIII异种皮下和原位模型显示,EGFRvIII靶向的CAR-T细胞可以控制肿瘤生长。
基于新抗原的抗体疗法
抗体疗法已成功用于治疗癌症,例如针对ICB的抗PD1 / PD-L1 / CTLA4抗体。与无法靶向细胞内蛋白的常规抗体相比,TCR模拟(TCRm)抗体或突变相关新抗原(MANA)特异性抗体可以通过聚焦pMHC复合物来识别细胞内新抗原。TCRm抗体比TCR具有更大的亲和力。这些新抗原靶向抗体易于转化为多种治疗形式,包括全长抗体、抗体-药物偶联物(ADC)和BsAb。TCRm抗体部分也可用于通过CAR-T疗法驱动新抗原的特异性活性,这已被证明在治疗某些癌症方面非常有效。
基于新抗原的免疫疗法和ICB
基于检查点抑制剂的免疫疗法在几种恶性肿瘤中取得了长期的抗肿瘤作用,包括肾细胞癌、NSCLC和黑色素瘤。然而,在没有肿瘤特异性效应T细胞的情况下,患者对ICB治疗没有反应。新抗原载量和肿瘤内异质性可以作为ICB反应的预测生物标志物。通过将ICB与基于新抗原的免疫治疗方法相结合,可以增强肿瘤反应性T细胞,从而实现更有效的抗肿瘤反应。与单药治疗相比,新抗原疫苗(PancVAX)与两种检查点调节剂(如抗PD-1和激动剂OX40抗体)联合使用可改善肿瘤消退。
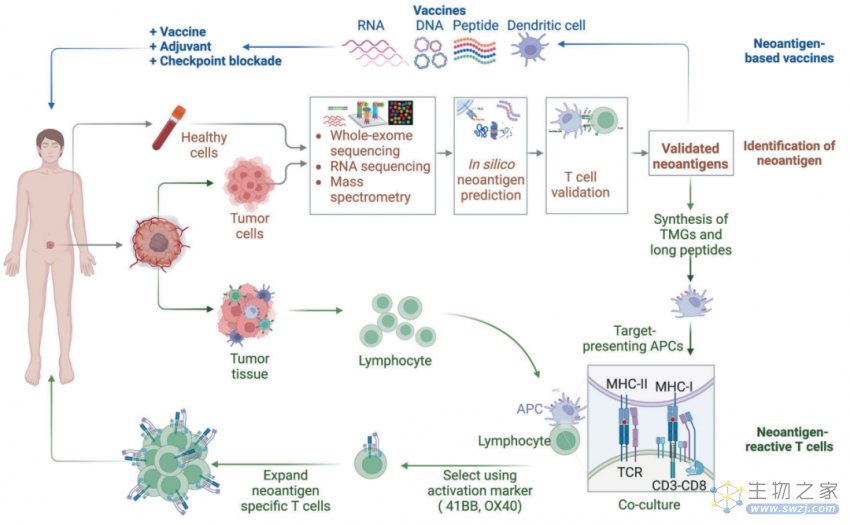
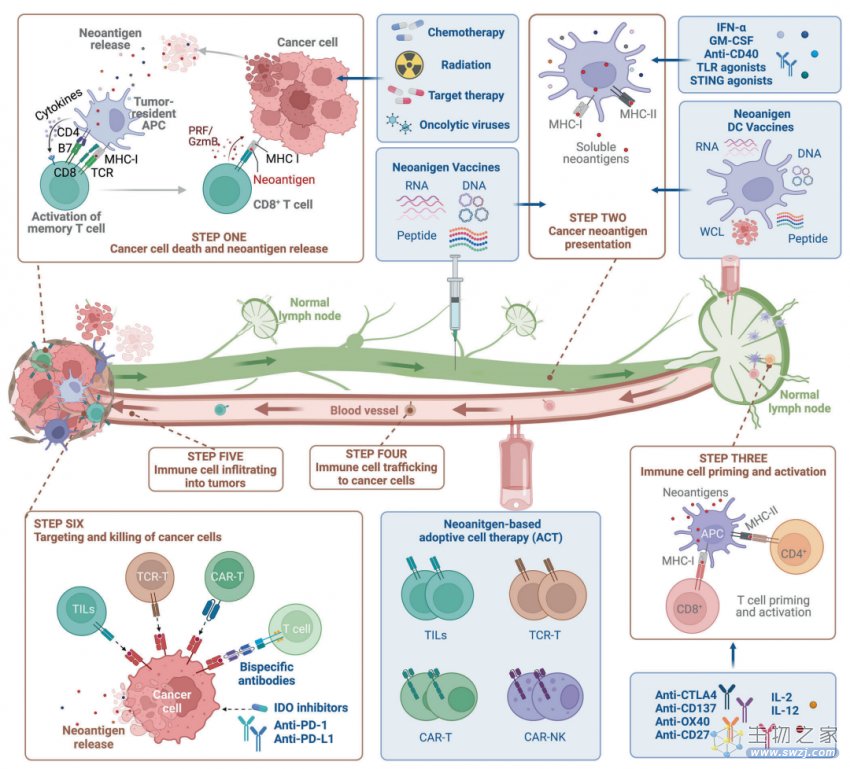
图4:基于新抗原的癌症免疫疗法的生产示意图
目前,新抗原的免疫疗法仅在少数有据可查的患者反应中显示出客观疗效。仍需要进行多种改进来改善其疗效,包括提高新抗原预测的准确性,克服免疫逃避,优化生产过程和有效招募患者。总体而言,新抗原在癌症免疫疗法中起着举足轻重的作用,拓宽了肿瘤治疗思路,具有广阔的发展前景。































