朝阳初升,总是汇聚着无限的希望。然而当迷雾来袭,往往也最易反衬出巨大的不确定。新生儿重症监护室(NICU)便是这样一个未知与遗憾会被无限放大的地方。
答案在深处,道路多曲折
在转院之前,1 岁的小患者修修(化名)已经经历了半个月的肺炎、发热,并在当地医院接受了十余天的住院抗感染治疗,但高血糖和发热始终不见好转,骨髓穿刺、B 超、胸片、脑部磁共振等系列检查都没能找到答案,不会说话的修修只能通过大哭宣告自己的不适和对种种检查的不满。
转院后修修又被发现了贫血、心颤、极重度耳聋等病症,这让主治医师产生了疑问:「在同一个孩子身上同时有好几种病,这种罕见的情况通常就指向了遗传缺陷。」经过基因检测,修修的病最终揭晓了谜底——硫胺素反应性巨幼细胞性贫血综合症,一种被称为「罗杰斯综合症」的罕见病。
答案浮出水面,「破题」的最优路径也便豁然开朗。通过维生素 B1 治疗,修修的贫血与高血糖很快得以缓解。只是,解谜的过程极为坎坷,让幼小的修修历经了重重苦痛,给这个家庭带来了巨大的财务压力的同时,也给修修带来了终身的「无声」遗憾。
而修修又是相对幸运的,毕竟还是等到了生命的转机。事实上,全球现在已知的罕见病有 7,000 余种,80% 都与遗传有关[1],也是导致新生儿死亡常见原因[2]。
图说:新生儿罕见遗传病诊疗往往是新生喜悦与遗憾的剧烈碰撞
病情进展快速的遗传性疾病映射到新生儿身上,遗憾就可能被无限放大。一方面,无论是产前还是产后,由于病例稀少,医生难以累积足够的临床经验,「能够诊断罕见病的医生比罕见病的病人还要少」,国家儿童医学中心、复旦大学附属儿科医院分子医学中心副主任吴冰冰坦言。另一方面,「遗传性疾病在临床早期可能症状是不典型的,同时又有危重症表现,会把这些不典型的罕见病症状掩盖掉,给我们临床医生诊断带来很大的困难。」让吴冰冰副主任尤为痛心的是,在完善诊断的过程中,患儿往往需要经过多次血样采集和相应的实验室检测,包括侵入性的操作或其它辅助检查,但有时仍无法得到明确的诊断结果。而「这些疾病往往进展非常快,如果不能及时诊断病因,就可能会导致致死、致残的不良后果。」
目的地就在那里,却只有经验足够丰富的「老司机」才可能抵达。但「老司机」毕竟只是少数,如何能让更多的医生也能穿越迷雾,快速、精准地摸清诊疗路线,少走弯路呢?能否将诊断前移,从产前、孕前进行有效干预,以减少重症新生儿的悲剧呢?
从 2011 年起,国家儿童医学中心、复旦大学附属儿科医院副院长周文浩教授便带领着他的团队,将答案锚定到「基因检测」上。
「我们曾针对 NICU 的死亡原因进行过分析,发现超过三分之一的患儿存在遗传病。要防止出现缺陷,首先我们要去明确它可能会存在的一些遗传疾病,更精准的诊断,才有可能进行更有效的干预,去降低新生儿的死亡和后遗症的发生。曾经我们靠人工,现在靠技术探秘,这就需要我们在临床上推动基因检测。」周文浩教授表示。由此,复旦大学附属儿科医院分子医学中心*在 2011 年应运而生。
转瞬十三年,从一代测序(桑格测序)到二代测序(新一代高通量基因测序技术),从靶向测序到快速全基因组测序,分子医学中心的快速发展,也成为疑难罕见病孩子们个性化治疗和精准治疗的源动力之一。
* 科研机构,非独立医疗机构
生命竞速,分秒必争
作为国家儿童医学中心,复旦大学附属儿科医院聚集了大量的疑难、危重、罕见性疾病。正如新生儿科副主任王来栓表示,「很多患者经过了重重检查,甚至会有一些会因为误诊而病情进展,这些疑难或高危患者给临床提出了格外高的要求,只有先明确病因,才能进行相应的干预。」

图说:王来栓主任
「把罕见病里和临床相关的分子病因明确后,对每一种疾病精准分型,就能实现个体化分子病因干预,这对儿童专科有着非常积极和重要的现实意义。」周文浩教授多年来一直强调,「高水平的儿科罕见病临床转化研究平台建设是解决儿童健康问题的重中之重。因此复旦儿科整合了原有临床上与遗传性疾病密切相关的分型,聚集形成了一个完整意义上的分子医学中心,并进行了一系列的分子基因诊断技术的创新和探索,基因组检测如今也成为普遍的新生儿生育缺陷、遗传缺陷的筛查工具。」
而有了基因检测这条「通途」,下一步的课题便是如何更全面、更快速。
过往常见的靶向测序主要针对已知致病基因或感兴趣的基因,应用于辅助疾病的诊断和治疗;全外显子测序(WES)则是对基因组的所有外显子进行测序,而外显子序列大概占到人类基因组序列的 1% 左右[3],更多应用于鉴定单核苷酸变异或少量碱基的插入或缺失等。这样的测序方式对临床医生的经验要求极高,需要有基础判断,再进行相应的验证。这个过程就像开启一个「盲盒」,结果一旦未能发现异常,诊断就可能陷入了困局。
而全基因组测序(WGS)会对受检者基因组中的全部 DNA 序列进行检测,不仅覆盖了几乎全部基因的外显子序列,也覆盖了内含子序列。如此,获得分子诊断水平的关键性证据几率大大提高,也能辅助临床进行更精准的决策。
「快速」是 NICU 另一重紧迫的需求。如若能在可控的时间内对全基因组进行测序,医生便有了更多的把握去找到治疗的「最优解」。只是,实现「全而快」并非易事,2001 年,人类基因组的第一次测序就耗时约 13 年。
直至近年来,常规的基因检测也通常需要四至八周的时间,这对于躺在 NICU 里与时间赛跑的重症新生儿来说,无限漫长。新生的喜悦被巨大的未知反噬,加上沉重的经济负担,患儿的家庭往往会在悲怆的等待中选择放手。
五年前,三个月大的小茵(化名)因代谢性酸中毒被紧急送往 NICU,伴有抽搐、呼吸困难,异常脑电图。两个月后,小茵的父母总算拿到了基因检测报告——BTD 基因突变导致的生物质酶缺乏症。病因被揪出,就有了治疗的希望,然而,因为无力应对高额的重症监护费用以及照护压力,小茵的父母已然选择放弃治疗,那份「迟到」的希望,也在离去的小生命面前倍显苍白。
「对于危重症的孩子,我们节约一分钟,节约一小时,就无形中带给他一个生存的机会。」周文浩教授指出,「基于这种想法,我们推动了急速全基因组测序的技术方案,以带动整体医疗质量的发展。如今,全基因组测序的最快时间压缩至 21.5 个小时,这意味着极大程度地帮助患儿及家庭减少了从身体、精神到支出的消耗。」
而「不可思议」的速度背后,是医者们的坚定笃行与倾力推动。
「2017 年,我们利用自己研发的高通量测序分析流程,成功解决了 NICU 报告的大量发放问题,一个人一星期可以发几百例报告,阳性病人的结果在第一时间就知会医生。我们建立了快速的全外显子检测报告法,24 小时内可以把一家三口的全外显子的测序方法建立起来。」回溯分子医学中心的发展,周文浩教授如数家珍,「我们构建了症状、体征、实验室检查等有关键性提示的 HPO 的树状结构,能够迅速地把诊断和关键性的临床症状、体征、检查结合在一起,从而对每一个 HPO 条目形成不同的对疾病量化的可能性;我们也建立了一整套基因突变位点自动筛选系统,原本一两百种疑似的突变、位点,经过一套打分系统,可以缩减到两位数,极大地快速提升了效能。」
「2018 年,我们中心又研发了一套快速全基因组测序,解决了全国各地送来的临床诊断样本报告问题。基本上每个星期做两个轮回,每个轮回做 7 个家系,在这样一个快速全基因测序的过程中,我们不单纯解决了染色体缺失、重复的问题,单个点突变的问题,而且把遗传疾病的诊断跟宏基因组的检测也结合在一起,这就比较全面地把 NICU 的疾病检测清楚。」此外,在整合多维度临床数据的基础上形成了快速的智能化决策平台,以便呈现疑难危重症疾病快速的临床 GPS 定位系统。
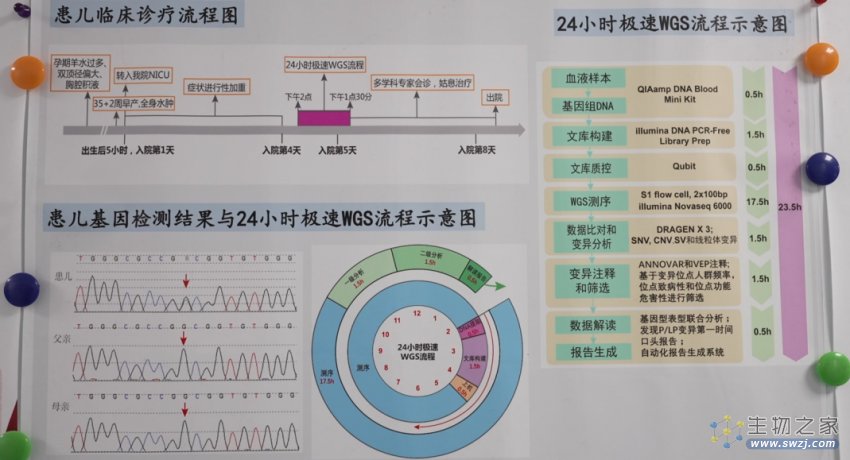
图说:24 小时极速 WGS 检测流程图
2021 年 7 月,中国首个《危重新生儿遗传性疾病快速全基因组测序专家共识》[4]正式发布,明确了快速全基因组测序的适用人群、实施流程、临床医生在基因测序过程中的具体工作、分子生物学实验室要求、基因检测数据分析等操作规范,为临床实施精准治疗决策提供依据,改善患儿预后。
同样因 BTD 基因突变导致惊厥和代谢性酸中毒的雅雅(化名)正获益于此。在快速全基因检测的辅助下,4 个月大的雅雅得到了及时的针对性治疗,通过生物素对症治疗,愈后良好,现在过着相对正常的生活。「同样的疾病,同样的起病年龄,由于诊断时效性不一样,两个孩子乃至两个家庭得到完全不一样的临床结果。」吴冰冰副主任坦言,「传统基因检测不能满足危重症患者快速诊断的需求,我们需要更加快速、高效、全面的检测技术的应用,协助临床医生早期明确病因,改善孩子的愈后。」
另一方面,除了辅助个性化治疗,快速全基因检测在医学经济学的角度也有着积极的意义。相关数据显示[5]:有 40% 接受全基因组测序的疑似患儿可能获得有效诊断,32% 的患儿因为检测而调整了临床治疗手段。大量住院和无效治疗因此得到控制。
或许,快速、全面的基因检测,会让 NICU 的遗憾再少一些,让孩子们的希望再多一些。
协力而行,冲云破雾正当时
为了及时为危重症的新生儿出具检测报告,一个大年初一的上午,吴冰冰副主任仍在加紧完成一项分析任务。
彼时,一个高度怀疑重症联合免疫性缺陷的孩子被紧急转院。接到来自临床的需求后,吴冰冰副主任立即组织团队启动快速全基因组检测流程,并最终在一天内给出检测结果,明确了其免疫性缺陷问题。
这样的快速响应在过去三年间反复上演。临床与实验室的通力配合,让快速全基因检测得以一次次实现。24 小时的实现,并非仅仅是技术本身的迭代,更需要紧密的跨部门合作,专业的团队打造等等,也是成本、技术、应用场景等多维度的共同推动。

图说:周文浩教授与团队合影
「在一个医院里,平台的建设、人才的培养、文化的营造,以及科室之间互相合作的精神非常重要,如果没有这些基本要素,凭借单打独斗,所取得的成效一定是有限的。」作为掌舵者,周文浩教授对复旦儿科分子医学中心人才建设以及团队合作有着明确的部署。
早在 2008 年,复旦儿科就邀请了哈佛大学波士顿儿童医院研究员、基因诊断实验室主任吴柏林教授来院交流访问,并讨论建立分子诊断实验室所需的人才培养计划。2012 年,吴冰冰副主任即作为外派访问学者之一,前往波士顿儿童医院基因诊断实验室进修。
这段赴美之旅让她颇为感触:「当时在国内针对遗传病的检测技术主要是染色体核型分析、一代测序等,到美国后接触到了更多前沿的分子诊断技术,包括那时刚刚兴起的高通量测序技术。」通过这次学习,吴冰冰副主任打开了分子医学的深度认知,不仅带回了前沿技术的实验流程,也掌握了数据分析、解读以及遗传咨询等技术。

图说:吴冰冰副主任与团队讨论分析病例(前排左二)
更有趣的是,出发那天,正值 2012 年 2 月 29 日。「四年一遇的日子,把我和罕见病连接在一起,像是一种预兆,我们自己的罕见病诊断也将越来越强。」吴冰冰副主任笑言。
而这的确只是一个开始。「基因就像一本深奥的天书,我们到现在仍未完全解码。未来的路还很长,相信通过不断的研究,我们会解开这本天书中更多的奥秘,让更多患者能够根据基因检测结果得到更及时的个体化精准治疗。」对于未来,周文浩教授有着长远的期待和信心。
当然,推行快速全基因检测,惠及更多患者,最迫切的是突破「人」这一关。「我们需要一支团队,」周文浩教授表示,「以强大的临床团队为支撑,通过丰富的遗传诊断经验和意识,能够及时向实验室提出需求,并根据检测结果对症治疗,同时还要定期随访,进行临床评估。同时,实验室也需要操作、分析、审核等等流程的专业人才,与临床紧密配合,相辅相成。」
而在吴冰冰副主任看来,分子医学中心的建设需要有长期的投入和决心。「从场地、设备,到人员配备、流程优化,每一个环节都需要医院的大力支持」
而放眼未来,周文浩教授也正将视野落在「再早一步、再进一步」之上。「出生缺陷防控是三级预防的最后一道防线,早期筛查、早期诊断、早期干预,我想高品质的医疗一定是以病人为中心的,以降低死亡率和后遗症的发生率为重要出发点。」而另一方面,凝聚一支高质量的医护团队,打造医患间和睦沟通,营造良好就医环境,高质量的发展也将让更多患者受益。
这不仅仅是一位院长、一个实验室、一家医院的目标,更是整个社会协力奔赴的未来。
云开雾散终有时。正如周文浩教授的初心与梦想,再离需求近一点,再向前「冲刺」一步,新生儿罕见病诊疗的未来,一定会看见更多的光芒。
本文仅供医疗卫生等专业人士参考
参考文献
[1] 王雪, 赵聪, 许淑红,等. 我国罕见病用药可及性现状分析[J]. 中国临床药理学杂志, 2021, 37(8):7.
[2] 肖非凡, 卢宇蓝, 吴冰冰,等. 采用全基因组测序技术快速诊断危重症新生儿的临床实践[J]. 中国当代儿科杂志, 2023, 25(2):5.
[3] 柯海萍, 杜振方, 张咸宁. 全外显子组捕获测序技术在单基因遗传病研究和诊断中的意义[J]. 中国优生与遗传杂志, 2012, 20(6):4.
[4] 吴冰冰,杨琳. 危重新生儿遗传性疾病快速全基因组测序专家共识[J]. 中国循证儿科杂志, 2020, v.15(05):5-8.
[5] Dimmock D, Caylor S, Waldman B, et al. Project Baby Bear: Rapid precision care incorporating rWGS in 5 California children’s hospitals demonstrates improved clinical outcomes and reduced costs of care[J]. The American Journal of Human Genetics, 2021, 108(7): 1231-1238.































