早在上世纪六七十年代,科学家们就发现了癌细胞中存在一类微小染色体,之后发现这些没有中心粒和端粒的 DNA 元件是环形的,大小为几个 Mb。
直到2013年,加州大学圣地亚哥分校的 Paul Mischel 教授在 Science 期刊发表论文【1】,指出这些染色体外DNA(ecDNA)与癌症及靶向治疗耐药性有关。此后,Paul Mischel 教授发表了一系列 ecDNA 与癌症的研究论文。
2023年4月12日,斯坦福大学 Paul Mischel、张元豪、得克萨斯大学西南医学中心吴思涵等人在 Nature 期刊发表了题为:Extrachromosomal DNA in the cancerous transformation of Barrett’s oesophagus 的研究论文。
之前的研究表明,染色体外DNA(ecDNA)结构在人类癌症中广泛存在,尤其是在晚期肿瘤中,但在健康细胞中很少发现。而这项最新研究发现,ecDNA甚至可以在癌前细胞中出现,它们的存在启动了细胞癌变。阻止这些ecDNA的形成,或者阻止它们对细胞的影响,可阻止癌症发展,这或将带来更好的癌症治疗方法。
这项研究揭示了 ecDNA 可以通过几种不同的机制促进癌症发展,阐明了 ecDNA 是如何在癌症全面发展之前出现的,表明了 ecDNA 不仅仅是基因组不稳定的晚期表现,这些发现提高了早期干预或预防携带 ecDNA 的癌症患者发展的可能性。

论文第一作者、加州大学圣地亚哥分校的计算机科学博士后研究员 Jens Luebeck 表示,这项研究结果表明,ecDNA 的形成不仅仅是发生在晚期癌症中的“一次性”事件,而是一个持续的过程,甚至开始于癌前组织,在癌症研究中,我们一直在寻求了解癌症对治疗产生耐药性的机制。这项研究提供了 ecDNA 等耐药机制的发生时间和地点,就可以针对性寻找癌细胞弱点,开发更好的治疗方法,从而改善癌症患者的预后。
ecDNA 上的癌基因扩增驱动肿瘤的进化及其对治疗的耐药性,并与癌症患者的不良预后有关。然而,目前尚不清楚 ecDNA 是究竟是基因组不稳定的后期表现,还是从发育不良转变为癌症的早期事件。
解密ecDNA在癌症中的作用,是美国国家癌症研究所和英国癌症研究所在2022年授予的四项2500万美元的癌症大挑战之一,他们资助了多学科研究团队,以解决医学科学中一些最棘手的挑战。
在这项研究中,加州大学圣地亚哥分校的 Vineet Bafna 教授团队负责基因组学分析,多年来,他一直与 ecDNA 研究先驱 Paul Mischel 教授团队合作,开发数学和计算技术,以识别 ecDNA 和染色体的其他结构变化。
在这项研究中,研究团队转向了癌症发展的一个具体例子——患有巴雷特食管的人。当食管下部的细胞被胃酸反流破坏,变得更像肠内壁的细胞,而不是健康的食管组织时,就会发生这种情况。大约1%的患有巴雷特食管的人会患上食管癌,食管癌很难治疗,死亡率很高。患有巴雷特食管的人通常要通过内窥镜检查和异常组织的活检来进行监测,由于这些频繁的活组织检查,研究人员可以获得在癌症发生前后收集的组织样本。
研究团队对在剑桥大学或弗雷德·哈奇森癌症中心接受治疗的近300名巴雷特食管患者或食管癌患者进行了活组织检查,评估了ecDNA的流行程度,确定了它们携带的基因,并对个别癌症发展的患者进行了研究。
为了更好地理解 ecDNA 的发展,研究团队分析了食管癌或巴雷特食管患者的全基因组测序(WGS)数据。这些数据包括来自剑桥大学的巴雷特食管监测和食管癌队列的206例活组织检查。还分析了来自弗雷德·哈奇森癌症中心的80名患者的活组织检查的WGS和组织学数据。
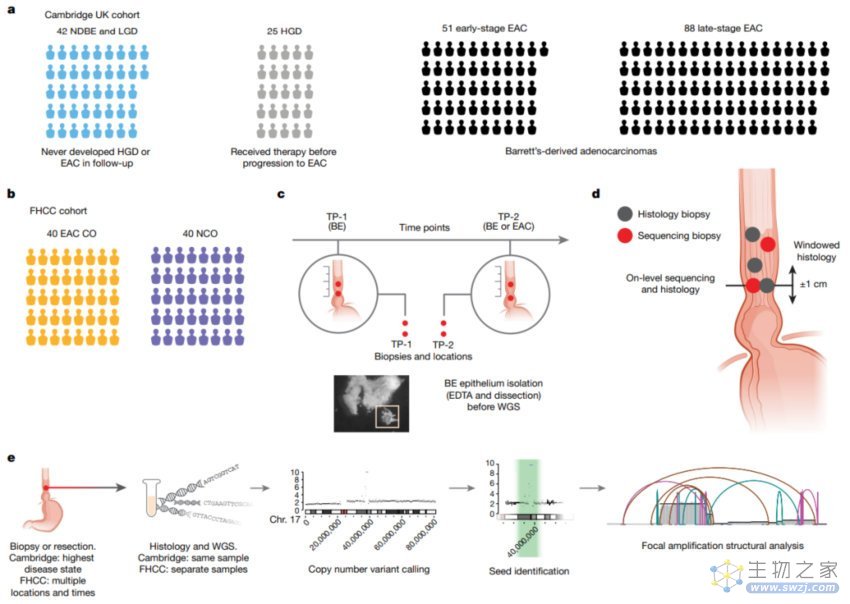
研究结果显示,在剑桥大学队列中,巴雷特食管相关早期阶段与食管癌晚期阶段相比,ecDNA 的发生率从24%增加到43%,这表明 ecDNA 是在癌症进展过程中持续形成的。而在弗雷德·哈奇森癌症中心队列的数据更能说明问题,他们发现33%患有巴雷特食管并发展为食管癌的患者的癌前细胞中存在ecDNA。相比之下,40个没有发展为癌症的巴雷特食管患者中,只有一个人的细胞中存在ecDNA,而且这个人是因为其他原因去世。
此外,该研究还发现,ecDNA 中包含了多种致癌基因和免疫抑制基因。而在食管癌的更晚期,ecDNA 显示出拷贝数和结构复杂性的增加。
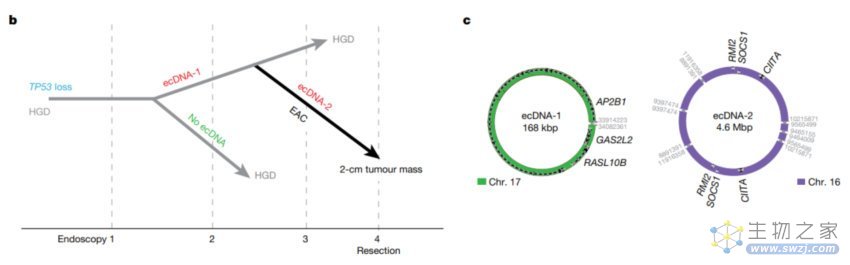
总的来,这些研究结果表明,ecDNA 可以在高度分化不良向癌症转变的早期发展,并且 ecDNA 在正选择下逐步形成和进化。
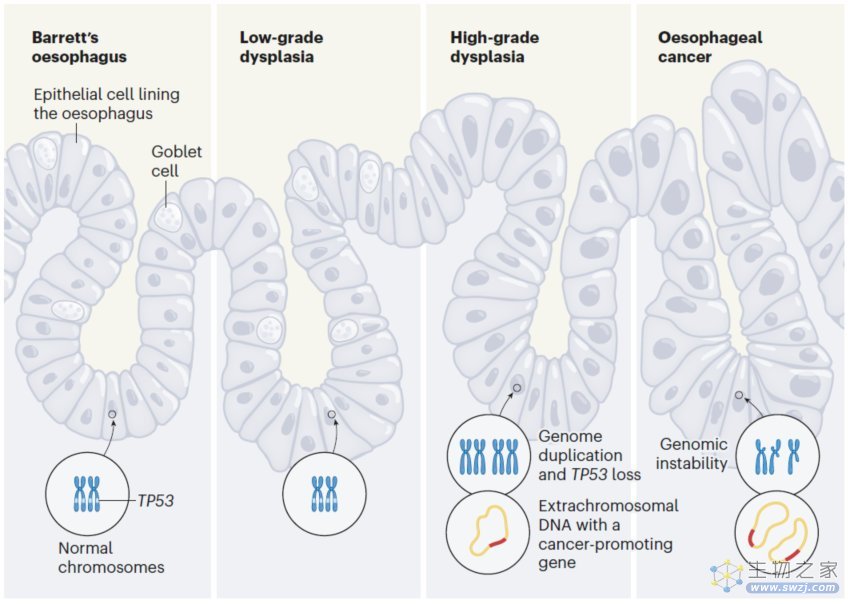
食管癌发展过程中的变化
论文链接:
https://www.nature.com/articles/s41586-023-05937-5































