端粒缩短是细胞衰老的特征,它们的长度是由基因决定的。研究发现短端粒会加速癌症的发生,已经在缺乏端粒酶的酵母中观察到染色体重排和突变率的增加【1】。短端粒综合征(STS)是典型的早衰综合征,骨髓增生异常综合征和急性骨髓性白血病构成了STS中最常见的恶性肿瘤【2, 3】,这些肿瘤是如何克服遗传性端粒维持缺陷以维持其进化的,目前还不清楚。
2023年3月30日,来自约翰霍普金斯大学医学院的Mary Armanios团队在Cancer Cell杂志上发表了一篇题为 T cell immune deficiency rather than chromosome instability predisposes patients with short telomere syndromes to squamous cancers 的文章,他们首次报道了一项针对过去20年收集的STS患癌个体数据的分析结果,发现STS患者的染色体不稳定性没有增加,但获得了端粒维持机制,且STS患者具有T细胞免疫缺陷,指出与免疫监视缺陷有关的因素驱动着鳞状细胞癌的发生。

为了了解端粒短在人类致癌中的作用,研究人员评估了2003年至2022年招募的226名STS患者中浸润性实体瘤的发病率。实体瘤的累积发病率随着年龄的增长而增加,但低于血液系统恶性肿瘤的累积发病率,几乎所有的实体瘤都来自于鳞状上皮,最常见于头颈部、肛门和皮肤等部位。有趣的是,这些实体瘤的发生与性别相关,几乎都发生于男性,但血液学恶性肿瘤在男女之间平均分布。为了评估实体瘤如何克服种系端粒缺陷,研究人员进行了配对的肿瘤-正常组织高通量全基因组测序,几乎所有肿瘤都至少有一个TP53功能丧失的改变,大多数肿瘤获得了端粒维持机制,以端粒酶逆转录酶(TERT)启动子突变为主,多种端粒维持机制在一些肿瘤中并存。这些数据表明,STS中出现的实体瘤通过TP53的功能丧失克服了短端粒检查点,同时获得了端粒维持机制。
有意思的是,作者发现几乎所有患者在诊断时都有T细胞免疫缺陷(86%),50岁以前诊断的个体有原发性无诱因淋巴细胞减少症和严重的CD4+T细胞计数降低。SCCs(鳞状细胞癌)是在肺/肝移植后或在诊断STS前因假定的自身免疫性疾病而服用T细胞细胞毒性药物(如硫唑嘌呤或霉菌素)后被诊断出。T细胞免疫缺陷与SCCs的共同出现使他们假设端粒长度缩短可能会损害T细胞依赖的癌症免疫力。
为了验证这一点,作者设计了具有短端粒长度的端粒酶RNA缺陷小鼠(TR-/-),这些小鼠再现了STS患者的T细胞缺陷表型,包括其CD4+和CD8+淋巴细胞减少。为了测试端粒长度短对T细胞免疫监视能力的影响,作者对野生型和TR-/-小鼠植入肿瘤细胞,尽管野生型小鼠最初能监测到肿瘤,但14天后都变得检测不到了,相反,41%的TR-/-小鼠(32只中的13只)有可测量的肿瘤,且雄性小鼠产生的肿瘤比雌性大。为了了解免疫监视受损的机制,他们分析肿瘤浸润淋巴细胞(TILs)时,发现在所有组别中,最初存在明显的CD4+和CD8+ T细胞浸润,但到了第30天,TR-/-小鼠的TILs已经消失,基本上看不到CD4+T细胞,CD8+T细胞明显减少。
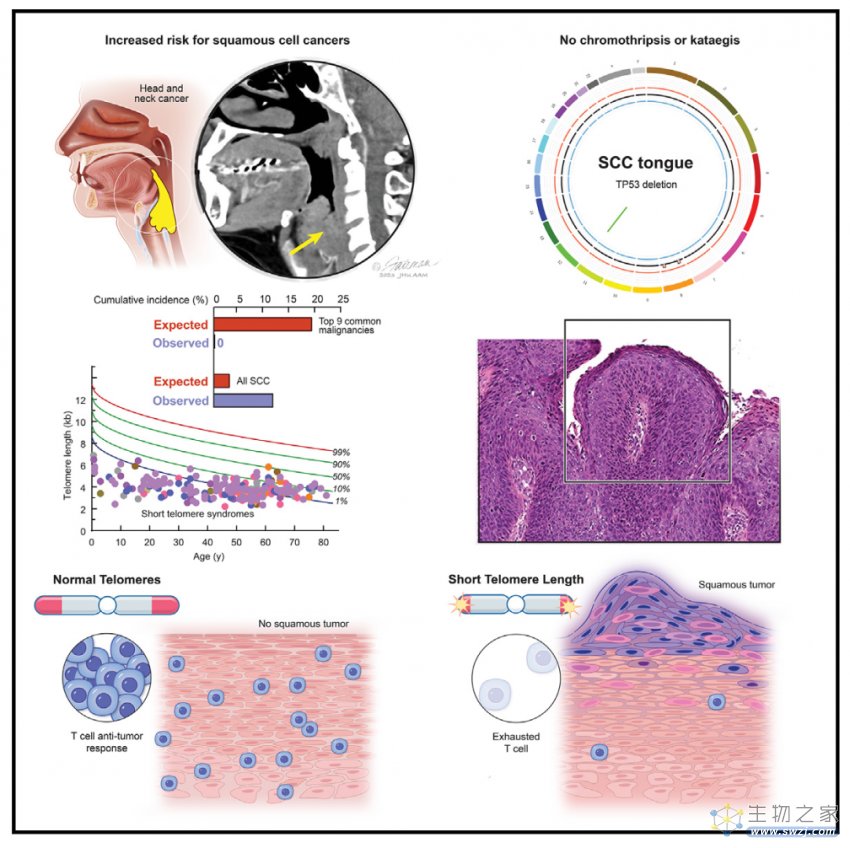
总的来说,这项为期20年的工作发现人类中短端粒综合征个体患鳞状细胞癌的风险增加,而同时患其他与衰老相关的癌症的风险却较低。这项研究结果对癌症筛查有临床意义,表明患有短端粒综合征的成年男性,特别是那些使用免疫抑制药物的男性风险最高,对这类对象进行针对性的筛查可能会有很高的收益。
原文链接:https://doi.org/10.1016/j.ccell.2023.03.005
参考文献
1. Hackett, J.A., Feldser, D.M., and Greider, C.W. (2001). Telomere dysfunction increases mutation rate and genomic instability. Cell 106, 275–286
2. Schratz, K.E., Haley, L., Danoff, S.K., Blackford, A., DeZern, A., Gocke, C.D., Duffield, A.S., and Armanios, M. (2020). Cancer spectrum and outcomes in the Mendelian short telomere syndromes. Blood 135, 1946–1956. https://doi.org/10.1182/blood.2019003264.
3. Alder, J.K., Hanumanthu, V.S., Strong, M.A., DeZern, A.E., Stanley, S.E., Takemoto, C.M., Danilova, L., Applegate, C.D., Bolton, S.G., Mohr, D.W., et al. (2018). Diagnostic utility of telomere length testing in a hospital-based setting. Proc. Natl. Acad. Sci. USA 115. E2358–e2365. https://doi.org/10.1073/pnas.1720427115.































