CRISPR Cas9基因编辑是目前流行的基因编辑技术,其原理是利用人工设计的引导RNA(gRNA)与Cas9核酸酶结合,靶向特定基因序列进行剪切和修饰。CRISPR/Cas系统经过进一步的改进和发展,将Cas9蛋白与具有脱氨酶活性的碱基修饰酶(例如APOBEC1、BE3、yABE7.10等)进行融合,则在近些年实现了对基因组DNA的单碱基编辑和修饰。
然而,由于难以将引导RNA递送到线粒体中,这一方法并不适用于线粒体 DNA (mtDNA)的编辑。线粒体作为细胞中种类繁多的细胞器之一,其地位十分特殊,它不仅作为细胞的“发动机”为细胞提供能量,还参与包括细胞凋亡、细胞周期调控、免疫应答等在内的一系列重要信号传递通路。线粒体还拥有自己的一套DNA,如果这套DNA出现异常,也可能引起多种疾病,如耳聋、视力受损、中枢神经系统疾病等。因此,开发能够编辑mtDNA的基因编辑技术意义十分重大。
目前,研究人员主要使用转录激活因子样效应子(transcription activator-like-effector,TALE)衍生的碱基编辑器来催化mtDNA的编辑。2018年,Mougous实验室在伯克霍尔德菌(Burkholderia cenocepacia)中发现了一种脱氨酶,由于能够在双链DNA上工作,因此命名为双链DNA脱氨酶(Double strand DNA deaminase,DddA)。之后,Mougous实验室与刘如谦实验室合作,将DddA与蛋白TALE结合,实现mtDNA的碱基从C到T的编辑。然而,这类碱基编辑器对序列的上下文有一定的要求,比如最初的碱基编辑器DdCBE只对跟在T之后的C有较高的编辑效率。
要突破这一局限,通常有两种方法,其一是工程化改造原有的编辑器,其二是寻找其他种类的编辑器。2022年,刘如谦等人通过噬菌体辅助进化的方法对DdCBE进行了升级,开发出了可以编辑跟在A、T、C之后的C的碱基编辑器。然而,跟在G之后的C仍没有适用的碱基编辑器。
近日,北京大学未来技术学院汪阳明实验室对多个来源于微生物的与DddA同源的双链脱氨酶进行了鉴定,并将其中一种成功改造成为线粒体碱基编辑器。2月16日,相关研究成果以“DddA homolog search and engineering expand sequence compatibility of mitochondrial base editing”为题发表于Nature Communications。

图1 研究成果(图源:[2])
研究的第一作者、汪阳明实验室的博士生米黎在研究伯克霍尔德菌DddA的序列和结构时发现,在其羧基端(C端)包含两个SPKK相关肽基序,其中S代表丝氨酸(Serine)、P代表脯氨酸(Proline)、K代表赖氨酸(Lysine)。它们更喜欢在双链DNA的小沟中结合富含A/T的DNA序列。删除这两个基序将消除DddA的脱氨酶活性,添加与SPKK相关基序相似的基序,使之具有类似的DNA结合特性(即偏好A/T),则能够恢复DddA的脱氨酶活性。
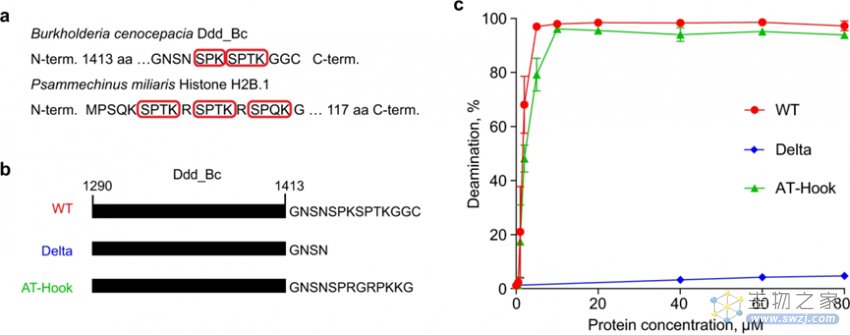
图2 SPKK相关肽基序对DddA的脱氨活性十分重要(图源:[2])
利用这一结果,研究人员对DddA的候选同源物进行了鉴定和筛选。研究人员注意到,一种来自于Simiaoa sunii的双链DNA脱氨酶(Ddd_Ss)在非TC序列上下文的情境下,具有广泛的脱氨活性。Simiaoa sunii是一种新近在中国温泉中被发现的细菌,属于芽孢杆菌科(Bacillaceae)的一个未知属,其命名源自于唐代医学家孙思邈。
使用不同DNA底物进行脱氨测定的结果证实,Ddd_Ss在面对紧跟着A、G、C或T之后的胞嘧啶残基都可以有效脱氨。这代表利用Ddd_Ss开发mtDNA 碱基编辑器将有望补上先前无法对紧跟G后的C进行编辑的缺口。
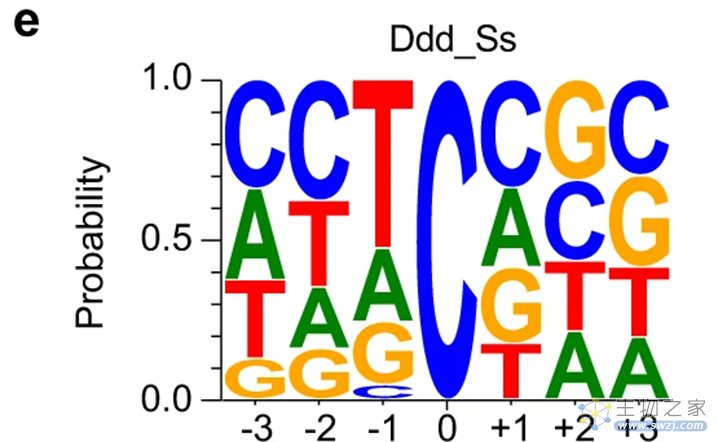
图3 Ddd_Ss对A、G、C或T之后的胞嘧啶残基都可以有效脱氨(图源:[2])
基于此,研究人员开发了开发了源自Ddd_Ss的DdCBE,并实现了对来自 10 个线粒体基因的14 个mtDNA位点的高效编辑。另外值得注意的是,通过从Ddd_Ss引入单个氨基酸到伯克霍尔德菌的DddA,研究人员成功提高了基于后者的碱基编辑器的活性和序列相容性,这为之后开发新的线粒体碱基编辑器提供了指导意义。
这项研究对于当前mtDNA编辑技术实现了可以在GC上下文进行编辑的突破,同时还对拓展线粒体碱基编辑器的序列兼容性指出了参考方向。但需要注意的是,基于Ddd_Ss开发出的碱基编辑器仍然存在广泛的脱靶问题。未来,还需要更复杂的设计来实现mtDNA高效和高度特异性兼顾的碱基编辑。
参考资料:
[1]未来技术学院汪阳明团队开发新的线粒体碱基编辑器
https://news.pku.edu.cn/jxky/c597042112544815a248ad0ae795f556.htm
[2]Mi, L., Shi, M., Li, YX. et al. DddA homolog search and engineering expand sequence compatibility of mitochondrial base editing. Nat Commun 14, 874 (2023). https://doi.org/10.1038/s41467-023-36600-2































