
2019年10月21日,基因编辑技术先驱刘如谦教授在 Nature 期刊发表论文【1】,开发了一种全新的精准基因编辑工具——先导编辑(Prime Editor,PE),其不依赖DNA双链断裂,且无需DNA供体模板,便可有效实现所有12种单碱基的自由转换,而且还能有效实现多碱基的精准插入与删除。该工具“原则上可以修复75000种已知致病性人类遗传变异的89%”。该技术已经得到全世界数百个实验室的验证,最近,刘如谦教授在第七届Chardan遗传医学年会上表示,将在2024年进行先导编辑的首次临床试验。
先导编辑(PE)系统包括两部分,一个含有DNA切口酶(Cas9 nickase,nCas9)和工程逆转录酶(RT)的融合蛋白;另一个是PE向导RNA——pegRNA。而先导编辑效率受到pegRNA的显著影响,因此,pegRNA的优化设计就极其必要和重要。
当前,基于规则的pegRNA设计方法仍受限于人类专家的专业知识和经验,而现有的几种基于机器学习的pegRNA设计模型非常依赖人工特征工程,准确性和泛化性有限,此外,它们还固有地缺乏可解释性。
2023年10月26日,重庆医科大学刘峰特聘副教授、西北农林科技大学王小龙团队和军事科学院军事医学研究院王升启/舒文杰团队合作,在 Nature Machine Intelligence 期刊发表了题为:Design of prime-editing guide RNAs with deep transfer learning 的研究论文【2】。
该研究设计和开发了一种可解释的核苷酸语言模型——OPED(Optimized Prime Editing Design),用来预测先导编辑效率和设计pegRNA。在各种公开数据集上的全面验证证明了OPED在不同情景下的广泛适用性,并且都显著提高了编辑效率(2.2-82.9倍)。
通过实验在PE2、PE3/PE3b和ePE不同编辑系统中都高效地安装了ClinVar数据库中各种类型的致病遗传变异,并且有着比现有的先导编辑设计工具更高的平均编辑效率,进一步确证明了OPED的多功能性和有效性。
研究团队从超过20亿个候选设计中构建了OPEDVar优化设计数据库,并开发了OPED网站(http://bicdb.ncpsb.org.cn/OPED),以用于任何期望的基因编辑。
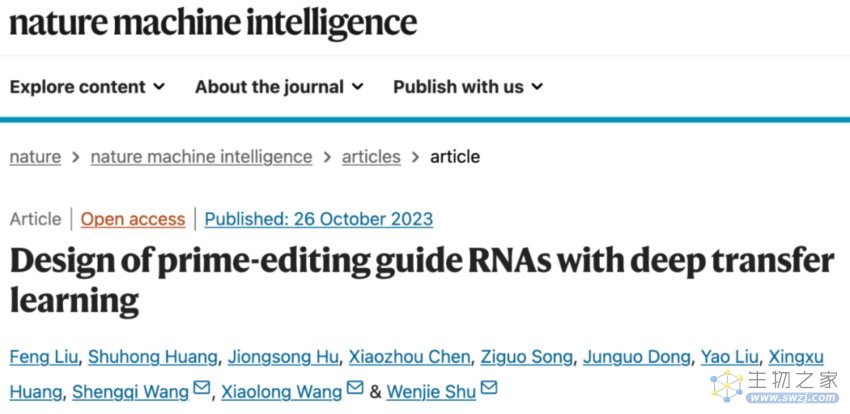
OPED可以自动从原始核苷酸序列中学习靶向DNA和pegRNA对的全面且可解释的表示,从而提高了其泛化性和准确性,而无需依赖预定义的人工特征。
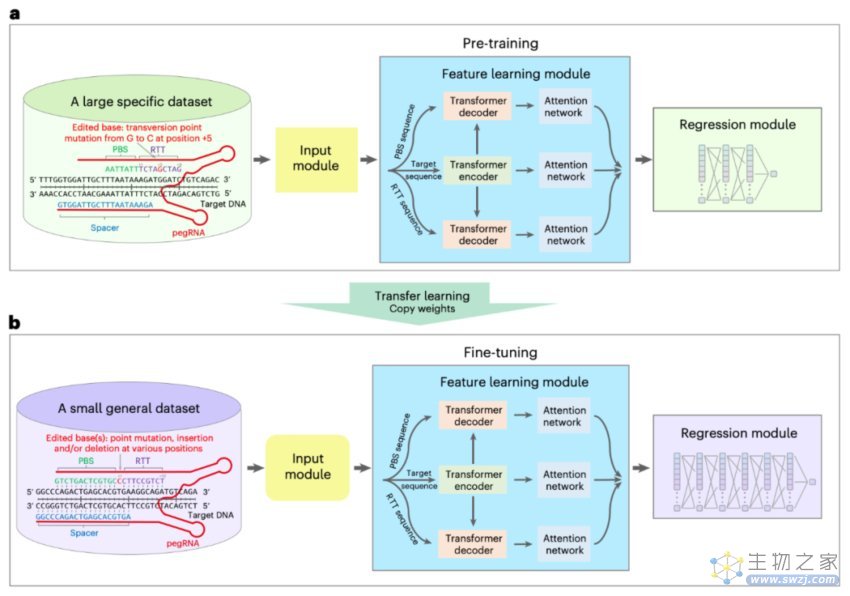
研究团队展示了OPED在不同的编辑类型、编辑位置、内源位点、实验室条件、tevopreQ1条件、错配修复抑制条件、体外细胞系和体内小鼠肝细胞中预测pegRNA编辑效率的普适性和准确性。值得注意的是,具有较高OPED编辑分数的pegRNA与在前述情况下具有较低OPED分数的pegRNA相比,其编辑效率明显更高(2.2-82.9倍)。此外,OPED的内在可解释性还揭示了影响pegRNA编辑效率的核苷酸水平因素。
研究团队通过使用OPED优化的PE设计(pegRNA和sgRNA)高效地安装了各种ClinVar致病遗传变异,验证了OPED的广泛适用性和优越性能。OPED推荐的PE设计在平均编辑效率上明显高于现有PE设计工具生成的设计(PE2,2.1-6.8倍;PE3/PE3b,7.9-24.6倍;ePE,3.4-47.5倍)。OPED在所有比较中始终优于现有PE设计工具。
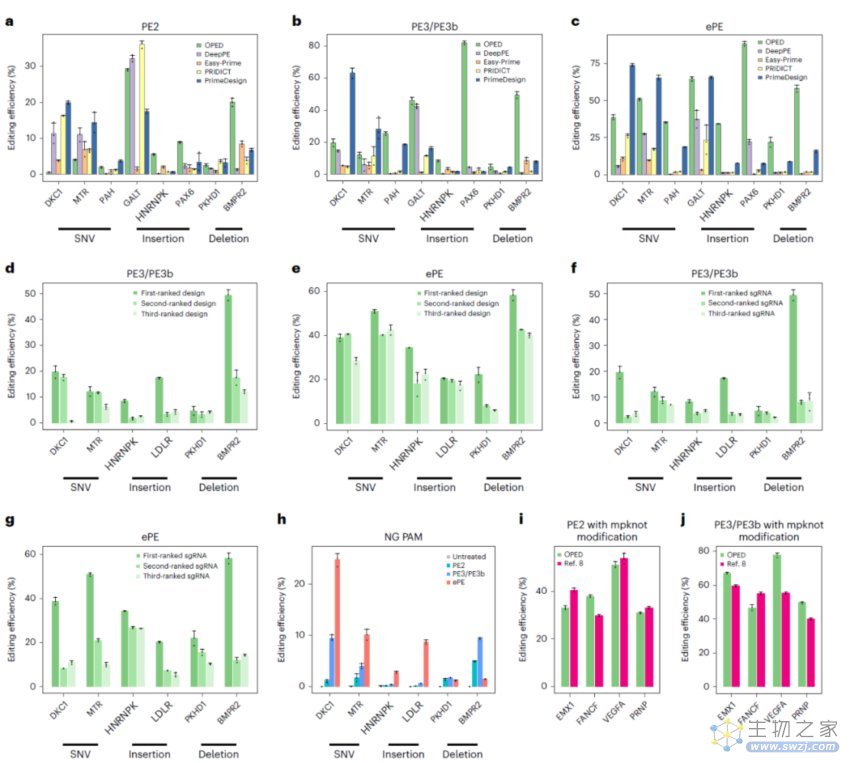
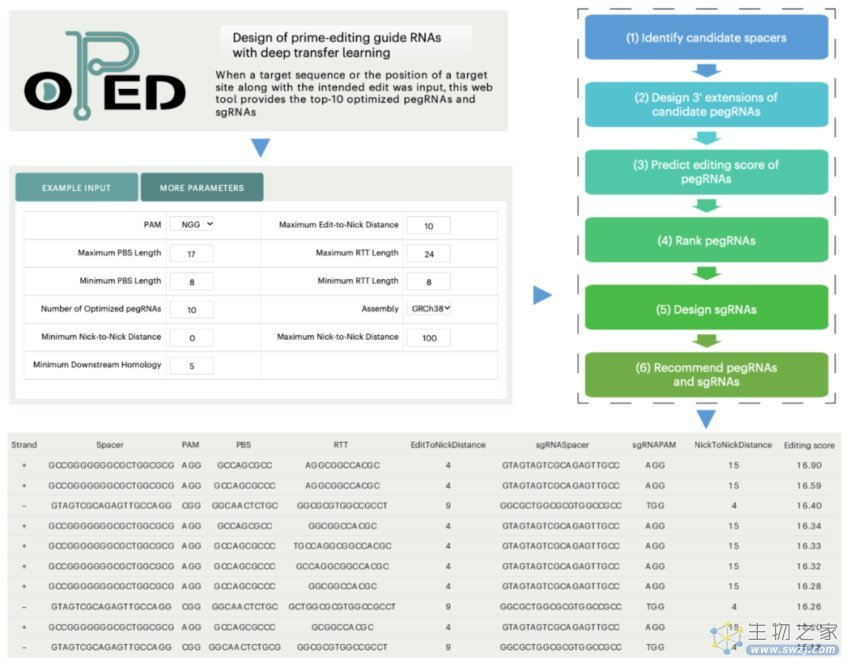
此外,研究团队构建了OPEDVar,这是一个包括针对超过77000个ClinVar致病变异的优化PE设计的综合数据库,以纠正或安装这些致病变异。研究团队还开发了用户友好的OPED网络应用程序,以简化为期望编辑设计pegRNA和sgRNA的过程。
论文链接:
1. https://www.nature.com/articles/s41586-019-1711-4
2. https://www.nature.com/articles/s42256-023-00739-w































