嵌合抗原受体T细胞免疫疗法(Chimeric antigen receptor T-cell Immunotherapy)简称CAR-T细胞疗法,属于过继免疫细胞疗法,通过基因工程体外修饰改造T细胞,使T细胞能特异性识别肿瘤抗原并杀死肿瘤细胞。与常规抗肿瘤药物不同,CAR-T细胞是活体药物,具有增殖能力和具有独特的细胞动力学特征,传统的药动学参数和药动学模型不适用于CAR-T细胞,影响因素包括抗原依赖性扩增、输注产品异质性和肿瘤微环境等。近年来已开发了定量模型描述CAR-T细胞动力学及其和肿瘤细胞的相互作用。本文主要简单介绍CAR-T细胞疗法和CAR-T细胞的体内命运。
01
CAR-T细胞疗法
什么是CAR-T细胞疗法?CAR-T细胞疗法首先提取患者自身血液中的T细胞,经过体外培养和基因工程改造,将带有特异性抗原识别结构域和T细胞激活信号的遗传物质转入T细胞,再经过纯化、扩增后回输入体内,能表达人工受体特异性识别特定的肿瘤靶抗原,从而杀伤肿瘤细胞。
CRA-T细胞疗法的制备步骤为:收集患者的血液样品,从外周血中分离纯化出自身T细胞,用基因工程将特异性识别肿瘤抗原的CAR转入T细胞,体外扩增CRA-T细胞并重新回输至患者体内,后续观察产品治疗效果和患者不良反应。CAR-T细胞疗法的制备过程如下:
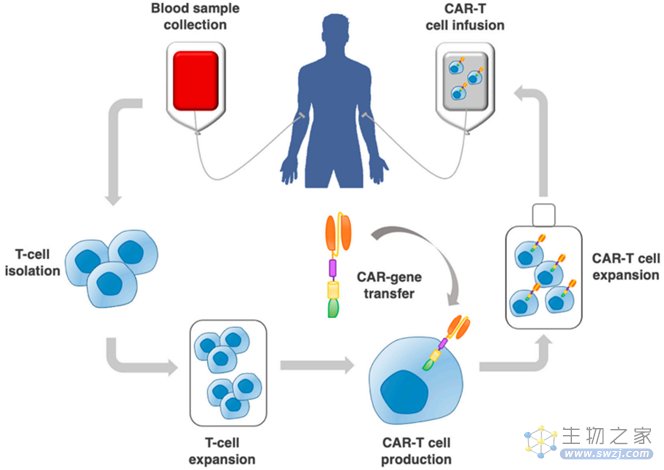
图1 CAR-T细胞疗法的制备过程
CAR-T细胞动力学特征:静脉输注后,CAR-T细胞分布到各种组织,导致循环CAR-T细胞密度暂时下降;在输注后的2-3周内CAR-T细胞增殖扩增到几个数量级并达到峰值浓度(Cmax);最后CAR-T细胞经历活化诱导的死亡,CAR-T细胞数量降低,也有小部分CAR-T细胞维持数月至数年的记忆细胞表型以产生持续的抗肿瘤活性。
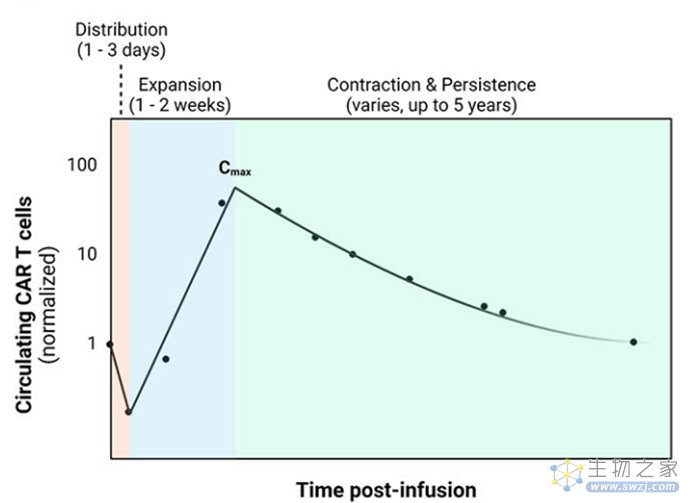
图2 代表性的CAR-T细胞动力学特征
02
CAR-T细胞的分布
CAR-T细胞在体外产生,通过静脉输注后快速分布,导致循环的CAR-T细胞数目在短时间内降低。研究表明CAR-T细胞的体内生物分布对治疗的疗效和安全性有重要意义。基于血液系统恶性肿瘤和实体瘤已经开发了表征CAR-T细胞生物分布、扩增、收缩和维持持久性的模型。在这些方法中,CAR-T细胞基于生理药代动力学(Physiologically-based pharmacokinetic,PBPK)开发的模型取得重要研究意义。PBPK模型结合了解剖学和生理学数据,比较不同组织间的灌注率,血管表示为模型的中央室,随后CAR-T细胞分布在不同组织(不同的外周室)。研究发现PBPK模型和正电子发射断层扫描(PET)相结合发现异种移植小鼠模型中肿瘤靶向的CAR-T细胞的生物分布明显高于人类,因此作者建议在小鼠模型中降低CAR-T细胞的给药剂量。CAR-T细胞输注后可分布在大脑,出现严重的神经毒性,神经毒性是CAR-T细胞疗法治疗淋巴系统恶性肿瘤的第二常见不良反应,CAR-T细胞可引发免疫效应相关神经毒性综合征的发作。在血液恶性肿瘤中,骨髓是CAR-T细胞与肿瘤细胞发生相互作用的主要部位,还分布在次级淋巴器官中。在实体瘤中,肿瘤床是CAR-T细胞与肿瘤细胞发生相互作用的主要部位,实体瘤中CAR-T细胞由于肿瘤微环境中的物理屏障,阻碍CAR-T细胞在实体瘤中的归巢和从血管中的外渗。
增强CAR-T细胞在肿瘤中分布的方法:
选择素、趋化因子和整合素及其配体可增强CAR-T细胞在肿瘤中的分布。研究发现炎症或放疗可诱导肿瘤血管中E-选择素的上调,可增强小鼠模型中T细胞浸润。PD-1抑制剂的使用可增强小鼠实体瘤中CXCR3配体的表达,可促进CAR-T细胞归巢到肿瘤部位。
在输注CAR-T产品前,消耗循环肿瘤细胞可改善CAR-T细胞的肿瘤归巢。在血液系统恶性肿瘤中,低水平的循环靶向抗原可导致CAR-T细胞的过早活化和CAR-T细胞在肺部的积累。
CAR-T的局部递送也可增强CAR-T细胞在实体瘤中的富集。例如在脑室内给药或瘤内注射CAR-T细胞比静脉注射对中枢神经系统恶性肿瘤更有效。
通过克服细胞外基质(ECM)造成的物理屏障或肿瘤相关成纤维细胞造成的屏障可促进CAR-T细胞在肿瘤部位的浸润。
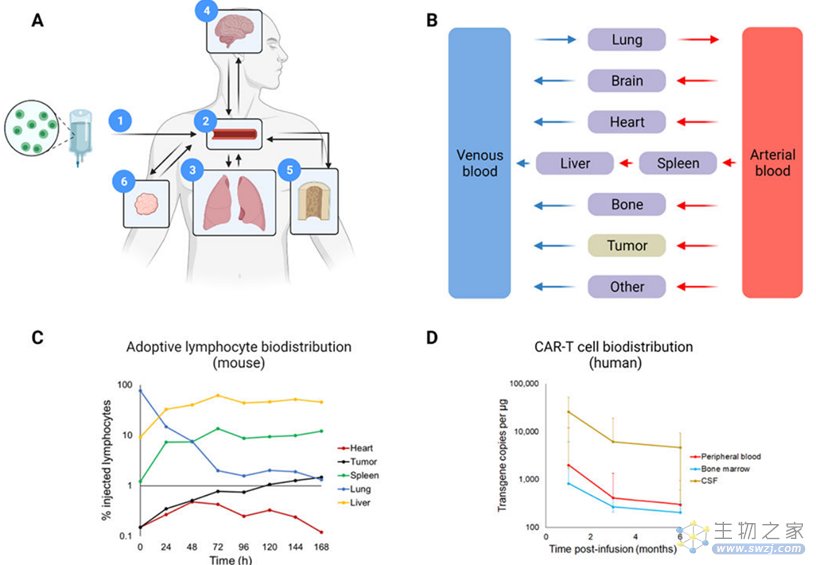
图3 代表性的CAR-T分布
03
CAR-T细胞的扩增
接受CAR-T细胞疗法的血液系统恶性中患者的临床反应与CAR-T细胞的峰值浓度(Cmax)有关,FDA批准的CAR-T细胞产品的疗效与Cmax成正相关(Ciltacabtagene autoleucel除外)。临床研究发现CAR-T细胞的体内剂量可跨一个或多个数量级,低剂量的CAR-T细胞可能不足以清除肿瘤细胞,但CAR-T细胞可通过复制、克隆来维持扩增和保持持久性。实体瘤中CAR-T细胞动力学与临床疗效的关系复杂,实体瘤的肿瘤微环境对维持CAR-T细胞的持久性和细胞增殖具有挑战性。研究发现接受抗CD2-CAR-T细胞治疗的黑色素瘤患者在第7日左右出现早期、短暂性的峰值浓度。CAR-T细胞的增殖速度比常规T细胞快,可能是对稳态细胞因子更敏感,受到肿瘤中促进增殖的内在信号或共刺激信号的影响,研究发现CD28共刺激结构域制备的第二代CAR-T细胞比含有4-1BB共刺激结构域的细胞扩增更快。与血液系统恶性肿瘤相比,实体瘤中CAR-T细胞的增殖能力较低。
CAR-T细胞的扩增不仅与肿瘤治疗效果有关,还与毒性有关。研究发现接受CD19-CAR-T细胞治疗的患者有较高的抗肿瘤效果,同时也与CRS和ICAS的风险相关。
增强CAR-T细胞的扩增方法:
通过自分泌或旁分泌产生细胞因子促进为CAR-T细胞增殖。
CAR-T细胞结构的设计可改善CAR-T细胞的扩增。第四代CAR-T分子能诱导细胞因子IL-12表达,促进CRA-T细胞扩增。
04
CAR-T细胞的持久性维持
CAR-T细胞疗法在B细胞恶性肿瘤患者中出现了持久的临床反应,这与CRA-T细胞的活性有关,CAR-T细胞可能产生长期的抗肿瘤反应。一项研究中,12例接受Tisagenlecleucel治疗的DLBCL患者,出现了长期的完全响应率,50%患者能超过5年检测到基因转录水平。CAR-T细胞疗法的持久性和疾病状态有关。研究发现由于功能性CD19-CAR-T细胞功能缺失,导致接受Brexucabtagene autoleucel治疗的ALL患者,在12个月便出现了外周B细胞的复发。CAR-T细胞的持久性也与结构域有关,研究发现含有4-1BB结构域的第二代CAR-T细胞与含CD28的细胞相比,持久性更强,更容易分化成CD8+中央型记忆细胞。
05
CAR-T细胞与靶细胞的相互作用
CAR-T细胞发挥功能最重要的一步是需要进入肿瘤。全身注射后CAR-T细胞先出现在非肿瘤部位,从肿瘤血管中渗透后到达肿瘤部位,通过复杂的细胞间相互作用促进T细胞活化,触发穿孔素和颗粒酶B的释放,最终诱导靶细胞死亡。研究发现CD4-CAR-T细胞和CD8-CAR-T细胞的杀伤动力学存在差异,CD4-CAR-T细胞对肿瘤细胞的单杀伤速度慢于CD8-CAR-T,细胞动力学效率的差异来源于颗粒酶的量,肿瘤细胞的密度也会影响CAR-T细胞的命运。
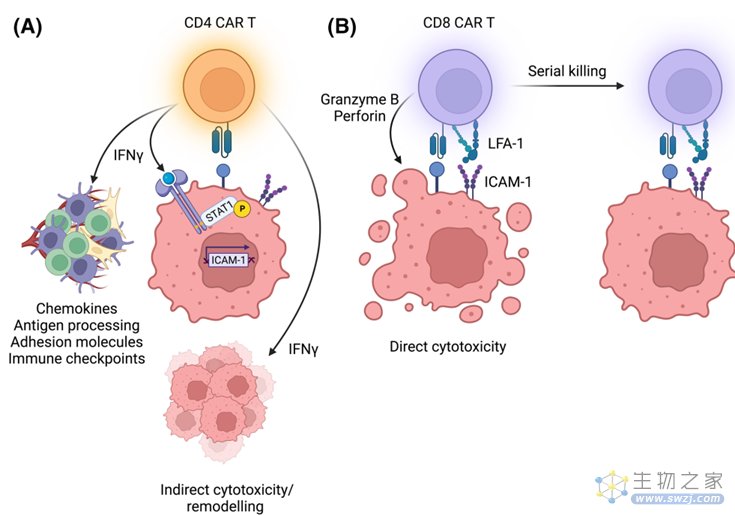
图4 不同CAR-T细胞的杀伤机制
06
CAR-T细胞的代谢
CAR-T细胞疗法的治疗效果和持久性与细胞的分化状态有关,分化程度低的T细胞亚群自我更新能力强,不同细胞亚群依赖不同的代谢程序,决定了T细胞免疫疗法的功能、寿命、持久性和治疗效果,CAR-T细胞疗法的成功受益于富含分化程度较低的CAR-T细胞,临床研究发现输注分化程度较低的T细胞与较好的临床效果成正相关。
T细胞的代谢受到肿瘤微环境的影响。活化的T细胞进行代谢需要竞争营养物质。研究发现肿瘤微环境中的葡萄糖转运蛋白1(Glucose transporter 1,Glut1)的表达与T细胞浸润和功能呈负相关。肿瘤上过表达的CD39和CD73,将ATP转换成腺苷,干扰NfκB的信号转导,抑制T细胞的抗肿瘤活性和诱导Tregs的产生,腺苷还影响T细胞的代谢,导致糖酵解代谢减少。肿瘤微环境中脂质的浓度升高可引发毒性,导致细胞死亡和T细胞衰竭。肿瘤微环境中的细胞因子对T细胞的代谢和分化有影响,炎症细胞因子如IFN-γ,IL-1β,IL-23和TNF-α可通过活化mTOR促进效应T细胞的富集。
CAR的结构影响CAR-T细胞代谢。研究发现CD28-CAR-T细胞相比,4-1BB-CAR-T细胞有更高的基础耗氧率。4-1BB共刺激使CAR-T细胞代谢偏向OXPHOS和FAO,并促进分化较低的表型。第三代CAR结构同时具有CD28和4-1BB共刺激结构域,保留4-1BB-CAR-T细胞的高线粒体代谢,伴随糖酵解代谢的增加,使得CAR-T细胞持续出现TCR信号、增殖和代谢适应度。
调节CAR-T细胞代谢的策略:
优化细胞培养条件。CAR-T细胞制造过程中的培养条件与分化状态和代谢表型有关。采用人血小板裂解物(Human platelet lysates,HPL)培养的CAR-T细胞,体内扩增更有优势,抗肿瘤活性更强。优化CAR-T细胞体外扩增时间,较短的时间间隔可生产出更强增殖能力、分化程度更低和最大细胞毒性的CAR-T细胞。使用合适的细胞因子,例如用IL-7、IL-15或IL-21替代IL-2,因为IL-2促进糖酵解导致细胞快速增殖,导致CAR-T细胞寿命变短和CAR-T细胞的分化度高。
干扰糖酵解,例如体外扩增过程中使用2-DG处理T细胞有利于记忆性T细胞的形成。
促进线粒体代谢,线粒体代谢和CAR-T细胞的感性和体内持久性有关。研究发现通过干扰PD-1/PD-L1途径可影响T细胞代谢,促进细胞存活和自我更新,使用抗PD-1抗体和苯扎贝特联合使用可降低T细胞凋亡。
提供合适的营养物质,肿瘤免疫微环境内部对营养物质的竞争可影响T细胞活性。研究发现L-精氨酸可促进记忆细胞形成和增强OXPHOS提高体外和体内T细胞的抗肿瘤活性。研究发现使用抗氧化剂可克服肿瘤微环境中ROS浓度高的问题,可维持T细胞健康。
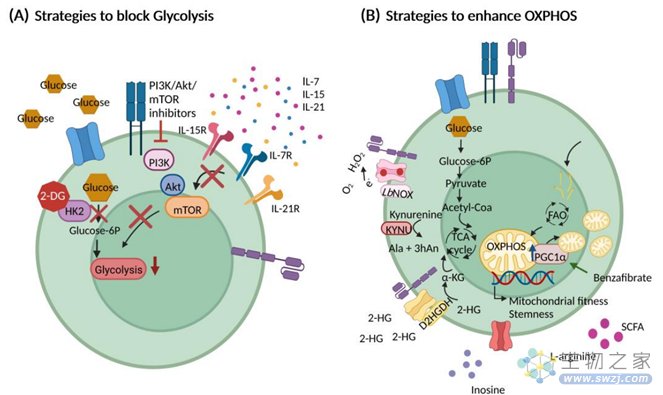
图5 调节CAR-T细胞代谢的策略
参考文献
[1] GUERRA E, DI PIETRO R, BASILE M, et al. Cancer-Homing CAR-T Cells and Endogenous Immune Population Dynamics [J]. Int J Mol Sci, 2021, 23(1): 405.
[2] ESPIE D, DONNADIEU E. CAR T-cell behavior and function revealed by real-time imaging [J]. Semin Immunopathol, 2023, 45(2): 229-239.
[3] QI T, MCGRATH K, RANGANATHAN R, et al. Cellular kinetics: A clinical and computational review of CAR-T cell pharmacology [J]. Adv Drug Deliv Rev, 2022, 188: 114421.
[4] RIAL SABORIDO J, VöLKL S, AIGNER M, et al. Role of CAR T Cell Metabolism for Therapeutic Efficacy [J]. Cancers (Basel), 2022, 14(21): 5442.
[5] 封面图来源:https://www.drugtargetreview.com/news/35921/cart-therapy-relapse/































