EB病毒模式图,图片来源:Mobitec
致命的偷袭
EBV(Epstein-Barr病毒)是一种广泛分布的人类病毒。据统计,全球超过90%的人口曾感染过,可谓无处不在。
EBV通过唾液等体液传播,大多数人在感染EBV时只是经历轻微的症状,并能自愈。然而,在免疫力低下时,沉睡状态的EBV可以重新激活,并趁虚而入引发疾病。
EBV潜入人体后,一方面它会引发传染性单核细胞增多症等自限性疾病,让人觉得它并不那么可怕。但在某些情况下,比如恶性淋巴瘤和鼻咽癌等,EBV却可以引发肿瘤的形成,让人“谈癌色变”。然而,对于EBV致癌的详细机制,科学家仍在不断研究当中。
就在近日,加州大学圣地亚哥分校、加州大学圣地亚哥分校摩尔斯癌症中心和加州大学圣地亚哥分校路德维希癌症研究中心的研究人员在《自然》杂志上发表了一项令人兴奋的成果。他们首次揭示了:EB病毒编码的EBNA1蛋白通过结合染色体11上的脆弱位点,诱发染色体断裂,从而可能导致癌症的发生。
简而言之:
1.EBV的蛋白质EBNA1会和宿主染色体11结合,导致染色体11上发生断裂,形成异常的结构。
2.即使处于EBV休眠状态的细胞中,EBNA1蛋白质水平稍微增加也足以引发染色体11的断裂现象。
3.鼻咽癌样本中约81%出现了染色体11上的结构变异,表明EBV相关鼻咽癌可能与这些结构变异的积累有一定关联。
这一研究首次证明了EBV如何选择性地诱导DNA脆弱位点的切割! 揭示了EBV与癌症之间的关联,为癌症的发生机制提供了新的视角,为癌症的治疗和预防带来了新的希望。
染色体的弱点 + EB病毒的致命偷袭 → 染色体断裂,导致肿瘤发生
作者提出:每个人的基因组都包含一些容易发生突变、断裂或缺口的脆弱位点。
这些大大小小的“软肋”可能与许多紊乱和疾病发生有关,包括一些遗传性疾病和癌症。
EBV则专挑这种软柿子下手,它编码的EBNA1蛋白能够通过结合特定的DNA序列,在宿主细胞核中形成外染色体。这样,EBV病毒就能够长时间埋伏在人体中。
此外,EBNA1通过与宿主细胞基因组的非特异性结合,像一股绳子把EBV基因组与宿主染色体连接在一起,维持EBV的潜伏状态和调控宿主基因表达。
以往的研究还发现,EBNA1可能通过抑制p53这个宿主的保护者、干扰PML体这个细胞的守门人,以及诱导氧化应激等机制,促进肿瘤形成。但EBNA1在肿瘤形成过程中具体作用仍存在争议。
作者猜测:EBNA1蛋白能够结合到人类染色体的簇状重复序列上,从而诱发染色体脆弱位点断裂,导致染色体不稳定。他们希望通过研究EBNA1如何诱发染色体脆弱位点断裂来更好地理解EBV如何导致癌症的发生。
研究正文
EBNA1结合位点在人类基因组中的确定:
研究人员设计了不同的EBNA1突变体,并将其转染到非EBV感染的细胞中。包括缺乏DNA结合结构域突变体以及具有其他结构域的突变体。通过荧光标记技术观察EBNA1在细胞核中的定位,并对不同突变体中的定位情况进行比较。
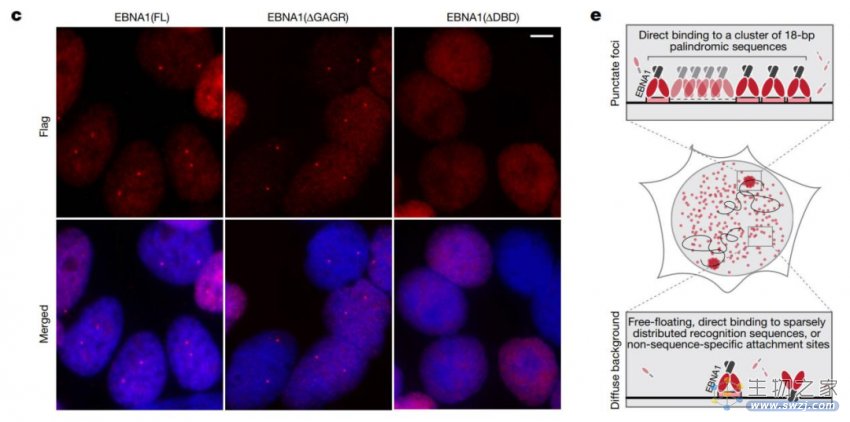
DNA结合结构域介导EBNA1在人类基因组中的特定位点富集
结果显示:
EBNA1在非EBV感染的细胞中呈现高度富集的斑点形式,而不是分散分布。
斑点富集的定位方式是通过EBNA1的DNA结合结构域介导的。
缺乏DNA结合结构域的EBNA1突变体无法形成斑点富集。
因此,研究人员认为在内源性人类基因组中可能存在一簇类似EBV的18-bp回文序列,EBNA1可能通过特异性结合该序列,在细胞核中形成斑点富集。这一发现为深入研究EBNA1在细胞中的功能和作用机制奠定了基础。
进一步证实EBNA1结合的调控机制:
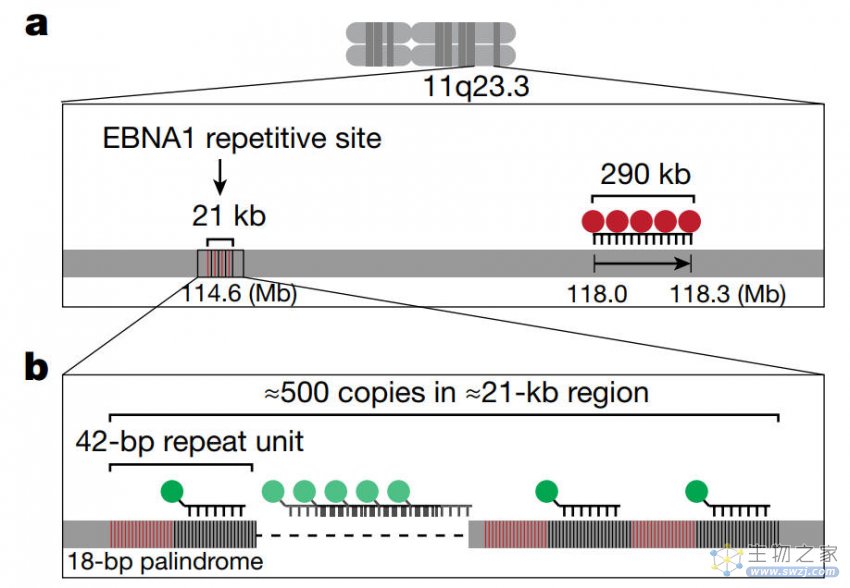
作者还使用了ChIP-seq(染色质免疫沉淀结合测序)技术鉴定了EBNA1在人类细胞中的结合位点,并通过CRISPR标记和切割系统验证了EBNA1结合位点位于人类基因组11q23区域的重复序列簇。
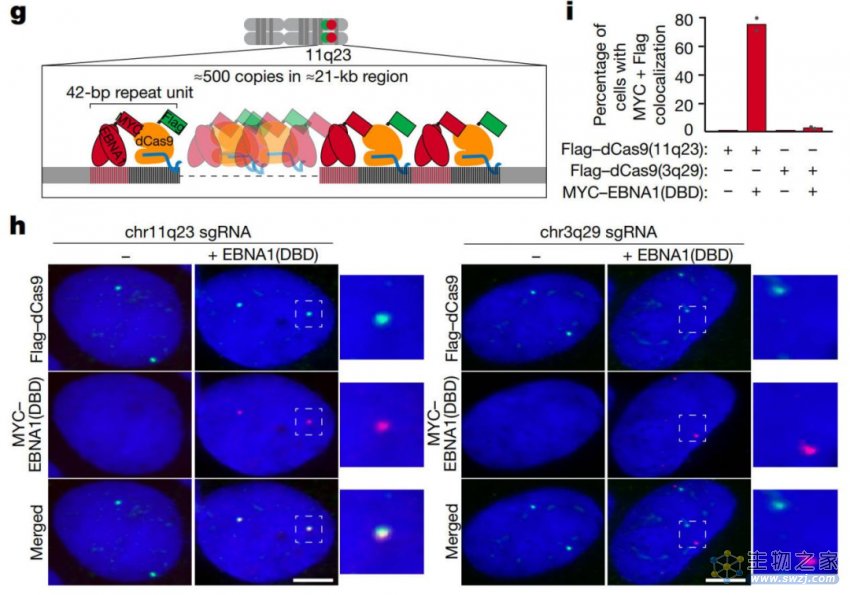
CRISPR标记和切割系统验证了EBNA1结合位点位于11q23的重复序列簇,
EBNA1结合位点的位置和形成受到特定重复序列的调控
实验结果显示:
EBNA1结合位点与11q23区域的重复序列簇存在高度的空间共定位。
并且EBNA1结合位点的形成受到这些重复序列的调控。
这项研究结果进一步确认了先前对于EBNA1与宿主基因组相互作用的研究,并揭示了EBV基因组中特定结合序列在EBNA1的结合调控中的重要性。
EBNA1结合诱发染色体脆弱位点断裂:
研究人员通过观察EBNA1蛋白结合位点的位置,并在有丝分裂期使用药物aphidicolin处理细胞,以探究EBNA1结合位点是否会导致染色体脆弱位点的断裂和DNA断裂与融合等异常结构的形成。
FISH实验中,BAC探针用于覆盖较大基因组区域,提供整体位置和上下文信息,类似于放大镜的大视野;寡核苷酸探针用于定位特定DNA序列,提供精确位置信息,类似于放大镜的小视野。同时使用两种探针有助于获得更全面和准确的实验结果。
结果显示:
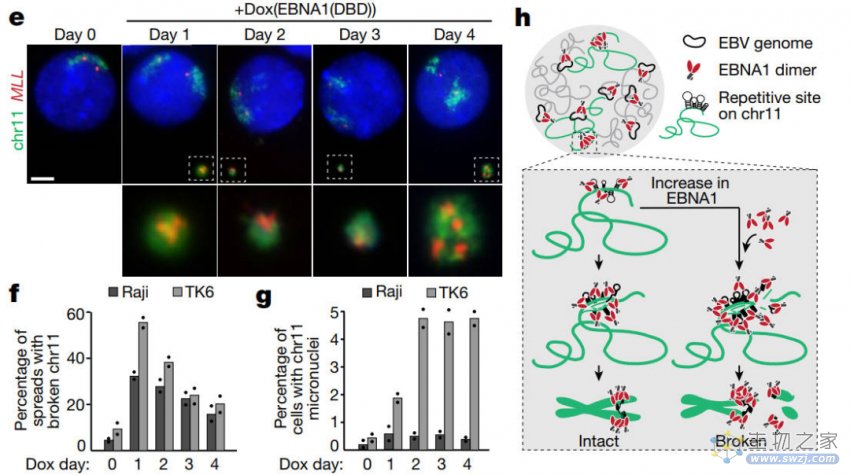
在诱导表达EBNA1后,含有18个碱基对的不完全回文序列的重复性DNA形成了具有脆弱DNA特征的异常结构。
EBNA1结合水平的增加会引发剂量依赖性的11q23断裂,导致一个融合着丝粒含量片段和一个无着丝粒远端片段的异常结构形成,这两者会在下一个细胞周期被错误分离到微核中。
这表明了EBNA1结合位点附近的DNA序列更易于形成染色体脆弱位点,并揭示了EBNA1在染色体脆弱位点的形成和染色体不稳定性中所扮演的重要角色。
EBNA1水平升高诱发染色体脆弱位点断裂:
研究人员通过观察EBNA1诱导的DNA断裂频率来检测EBNA1的剂量效应,以验证重复DNA序列的拷贝数与其脆弱性的相关性。
结果显示:
在潜伏感染EBV的细胞中,仅将EBNA1丰度提高两倍就足以触发11q23处的断裂。
并且EBNA1诱导的11q23染色体断裂频率与EBNA1的表达水平呈剂量依赖关系。
这表明即使在潜伏感染EBV的细胞中,EBNA1水平的轻微升高也足以诱发染色体脆弱位点断裂。从而进一步证明了EBNA1诱导的DNA断裂与其表达水平之间的关联。
EBV感染与鼻咽癌中结构变异的关联:
研究人员对78例EBV阳性的NPC患者进行了结构变异分析,此外,研究还分析了来自38种肿瘤类型的2439个癌症患者的全基因组测序数据。
结果显示:
在78例EBV阳性的NPC患者中,有63例(81%)在染色体11上出现了结构变异,其中32例呈现染色体11上近邻的聚集性结构重排。
且发现EBV阳性的肿瘤在染色体11上的结构变异较为丰富。
这一发现进一步验证了EBV与鼻咽癌(NPC)的密切相关性,特别是与染色体11上结构变异的富集相关。
小结
这项研究揭示了EB病毒利用染色体脆弱位点诱发癌症的狡猾手段:通过EBNA1蛋白与人类染色体11q23上特定的DNA序列结合,触发了剂量依赖性的11q23断裂,导致染色体不稳定。
这一发现揭示了EBV与染色体不稳定之间以前未被认识到的联系,为我们深入理解EBV如何诱发癌症提供了新的线索!也为未来对防治EBV相关肿瘤的研究提供了新的方向和可能性!
https://doi.org/10.1038/s41586-023-05923-x































