
这是一个发生了无数次的故事:O变成了A、B和C,B几天内就死了,C过了9个多月也死了,而A活了很久很久。这是为什么呢?因为最好的都给了A,A成了最完美的,而A的真实身份是很早之前的你。
从2到1,从1到100,再到100万亿。
这些都是细胞的数目,是一个卵子和一个精子结合形成受精卵,后者形成囊胚,再发育成一个新生儿的全过程。这是一个极其复杂的过程,其中会发生无数次的巨变。
如今,一个研究热点就是研究受精卵发育到10多个细胞时的情况。这时生命已经进入了桑椹胚阶段,未来的发展轨迹已初步显露。当进入下一阶段(囊胚期)时,生命会分化成内细胞团和外细胞团——前者会发育成胚胎,后者会发育成胎盘。
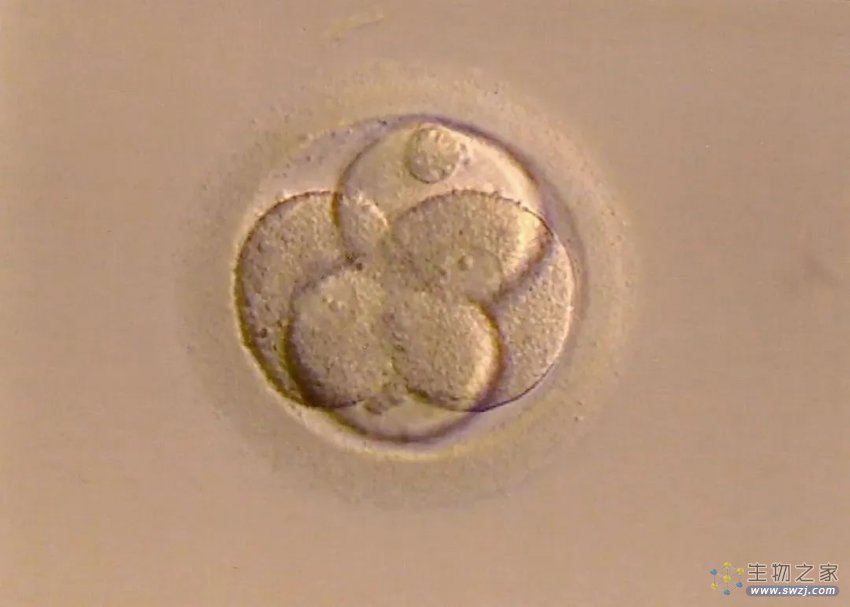
△ 受精卵
可以说,这一阶段中的每个细胞都弥足珍贵,拥有着巨大的发育潜力。但一些科学家却发现有一些细胞会程序性死亡——凋亡,也可以理解自杀。不过为何会如此呢?近期,在一篇发表于PLos Biology的研究中,德国、西班牙和英国的研究人员通过艰巨的计算分析,发现这些细胞的凋亡可能与一场在基因组中一直持续的古老战争有关。出乎意料的是,敌对双方都和“逆转录病毒”有关。
01
人DNA上的逆转录病毒
大量研究已经发现,在人的基因组中,一半的碱基序列是高度可重复的,不会表达蛋白质。其中,有一部分序列就是逆转录病毒形成的逆转录转座子。逆转录病毒之所以有这一名称,原因是它们的核酸是RNA。在进入人体后,它们能利用逆转录酶形成DNA,并将DNA插入到人的基因组中。而这些DNA就成了逆转录转座子。
这些逆转录病毒在漫长的演化中,插入人类的祖先体内,进入能够产生后代的精子或卵子时,给现今人类留下的“遗产”就是逆转录转座子。这些逆转录转座子在一段时间内,可能都是人基因组上的“寄生虫”。它们会利用宿主的资源不停复制、扩张。如果不加限制,它们必然会威胁宿主的健康。
△ 图中绿色的颗粒为HIV,它是一种逆转录病毒(来源:美国CDC)
而在2020年2月,一项发表于《自然综述·遗传学》(Nature Reviews Genetics)的研究表明,生命也演化出了复杂的防御体系,让很多逆转录转座子在经过多次改变后,失去了转录成RNA的能力,并为人类所用。
不过,这些基因组“寄生虫”可能永远无法消除。因为维持这样的防御体系需要消耗很多资源,当将“寄生虫”被清除后,生命就会慢慢放松防御。而此时,它们就会再次入侵。
在最新的研究中,科学家发现有一类基因组“寄生虫”在早期胚胎中十分活跃。这些都是年轻的逆转录转座子——在700万年内才进入到人类祖先的基因组中,人类细胞还来不及束缚住它们不断复制的本能。
02
早期胚胎中的战争
这些“寄生虫”活跃的时期就在胚胎基因激活(embryonic gene activation)后,到囊胚期早期之间。胚胎基因激活是新个体利用自身DNA控制自身发育的开端。在此之前,所有的活动还都是由母亲卵子中的RNA和蛋白质控制。
在这个全新的开头,基因组会大范围去除基因限制,促进基因的表达和活动。而这些原本在基因组中被抑制的“寄生虫”得到了机会,可以自由活动,并通过大量复制扩张自己在DNA上的领地。
实际上,这些“寄生虫”的活动还和这一阶段一种关键细胞——前种系细胞(pre-germline cell)的形成有关。这种细胞未来可能会发育为精子或卵子。这些“寄生虫”如果能在这一阶段扩张领地,便会有更大的几率能在人的DNA中长期存在。
正如上文所说,基因组“寄生虫”的领地扩张,必然会给正常细胞带来大量破坏。科学家也发现了它们带来的危害。科学家观察到在囊胚期早期,有一个名为NCC(没有特性的细胞)的细胞簇,大概有20%的胚胎细胞属于这个细胞簇,它们没有发育目标,而是在等待凋亡。
研究者发现,NCC不继续发育的原因,可能是由于“寄生虫”的领地大范围扩张导致这些胚胎细胞的DNA出现了很高水平的损伤。这些细胞中有很多响应DNA损伤的基因表达,而表达最活跃就是和凋亡相关的基因(BIK和BAK)。相比之下,同一时期的内细胞团(ICM)已经开始表达多种生物学标志,为后期发育做好了计划。
科学家检测到3类此前发现的、在胚胎中很活跃的转座子,都会在NCC中大量表达。而这些正好都是年轻的逆转录转座子,插入基因组后可能导致潜在的基因突变。其中包括L1转座子(LINE-1 or L1/L1_Hs),以及受L1转座子影响的SVA复合转座子和Alu转座子。
△ 人的基因组上有很多逆转录转座子(来源:Pixabay)
按理说,内细胞团也会面临逆转录转座子的威胁,但意外的是,它们能抑制这些转座子的活性,避免凋亡。那让两者命运差之千里的因素是什么呢?这个可能就和细胞内是否有“雇佣兵”(guns for hire)活动有关了。
这些“雇佣兵”实际上是细胞内比较年长的逆转录转座子——或许曾经也是基因组的“寄生虫”。这些逆转录转座子已经没有了原来的完整序列,反而成为了DNA上的功能单位。其中,转座子HERVH在激活转录后,其上特定的LTR7序列就会暴露出来。多个和细胞多能性相关的因子会结合在这一序列上,而这些分子对于早期胚胎细胞发育出多能性极其重要。
研究人员还发现,HERVH是否高表达,可能是决定细胞是继续发育(内细胞团)还是凋亡(NCC)的关键原因。当HERVH高表达时,它能抑制L1转座子等的活动,两者之间似乎存在一种拮抗作用。而只有这样的细胞最终才能进入内细胞团,具有全能性和发育迁移。如果细胞中的HERVH表达不足,例如在NCC细胞中,L1转座子的活动就会导致DNA损伤和细胞凋亡。研究人员发现了HERVH会促进一种抑制逆转录转座子活动的因子表达,进而抑制L1转座子的活动。
在研究人员看来,这些年长的逆转录转座子就像是胚胎细胞租用的“枪”,用来防御那些年轻、贪婪的逆转录转座子。实际上,这种情况可能并不少见,例如从细菌的天然防御机制中发现的CRISPR-Cas9系统就是一个类似的例子。细菌在CRISPR-Cas9系统的帮助下,能记录入侵的病毒,而后期再遇到类似的序列后,就能直接识别,并进行剪切和破坏。
03
最小的竞技场
考虑到NCC细胞注定凋亡、被排除在个体发育之外的命运,研究人员认为,早期胚胎或许是一个“淘汰竞技场”,会对胚胎细胞尤其是内细胞团进行了严格的质量控制。而这一切都是为了让最完美的细胞成为内细胞团,将来发育成生物个体。
基于这一假设,他们认为逆转录转座子活动及其带来的损伤,或许是区分胚胎细胞的一个原因。NCC中的细胞有可能是由于出现明显的DNA损伤,而被排出了内细胞团。不过针对其中的机制,科学家认为还有讨论的空间:NCC细胞或许是因为最初存在于错误的位置而注定要凋亡,于是对逆转录转座子的防御比较宽松;又或许是它们最开始对逆转录转座子就比较宽松。这些都有可能导致了NCC细胞由于严重的细胞损伤被排除在外。
除此之外,内细胞团的细胞与其他胚胎细胞之间还有一种差异,即染色体是否是整倍。在内细胞团中几乎不存在非整倍体的细胞,而那些有缺陷的细胞几乎都去往了人类的胎盘。
早期胚胎对将要发育成胎盘的外细胞团的质量控制,就相对宽松。研究人员发现在外细胞团中也有L1转座子的表达,但它们几乎不会像NCC细胞那样表达和凋亡相关的因子,反而是对L1的活动有了一定的耐受性。这也部分印证了早前的研究发现——人类胎盘具有很高突变率(部分是转座子复制引起),似乎是非整倍体细胞的倾倒场。
这可能是因为内细胞团之外的细胞,在未来只会存在有限的时间,例如NCC很快就会凋亡,由外细胞团发育成的胎盘也只会存在9个月,因此可能更能容忍转座子的活动。而由拥有无限发育可能、注定长久存在的内细胞团发育成的每一个你,是否也拥有无限可能呢?是的!
又是被自己的细胞感动的一天呢!
参考链接:
[1] https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002162
[2] https://www.nature.com/articles/s41576-019-0172-9































