肺癌是目前世界上最致命的癌症,Ⅳ期(分期较晚)患者的5年生存率仅为4%。肺癌的免疫检查点抑制剂(ICIs)通过阻断特异性信号通路来恢复和维持免疫系统对抗肿瘤细胞的功能,其中细胞毒性T细胞在免疫监测和抗肿瘤应答中发挥重要作用。与化疗相比,程序性细胞死亡受体1 (PD-1)/程序性细胞死亡受体配体1 (PD-L1)联合细胞毒性T淋巴细胞抗原-4 (CTLA-4)抑制剂具有更高的客观缓解率、更长的总生存期和更低的不良反应。今天,我们将深度剖析一项最新PD-1/ PD-L1抑制剂联合CTLA-4抑制剂疗法(Durvalumab+Tremelimumab)在晚期肺癌中取得的成果,望为广大肺癌患者以及医疗工作者提供新的见解与希望。
Tips:在阅读之前,建议您熟悉并了解以下专业术语,以便更好的阅读及了解文章内容:
总生存期(OS):是指从某个特定时间点(例如诊断时间或治疗开始时间)开始,直到患者死亡或失访或结束研究的时间为止的时间长度。
无进展生存期(PFS):是一种用于评估治疗效果的临床终点指标。它通常是指从治疗开始到出现疾病进展或死亡的时间,即患者在没有疾病进展的情况下存活的时间。
mNSCLC:指的是转移性非小细胞肺癌,是指肺癌已经扩散到身体其他部位,即出现了远处转移病灶。
帕博利珠单抗:是一种针对HER2受体的单克隆抗体,它可以与HER2受体结合并阻止其信号传导通路,从而抑制癌细胞的生长和分裂。
纳武利尤单抗:是一种针对PD-1受体的单克隆抗体,用于治疗多种恶性肿瘤。它可以与PD-1受体结合并阻止PD-1和其配体(PD-L1和PD-L2)之间的相互作用,从而激活抗肿瘤免疫反应,增强机体免疫力,达到治疗效果。
伊匹单抗:是一种人源性单克隆抗体,它属于CTLA-4抑制剂的化学药物,通过抑制CTLA-4信号通路来增强机体免疫反应,从而帮助身体抵御癌细胞。
PD-L1肿瘤比例评分:PD-L1肿瘤比例评分(TPS)是检测免疫检查点抑制剂治疗PD-L1表达的一种方法。
肿瘤突变负荷:是指肿瘤细胞中的突变总数或突变频率。它可以通过对肿瘤DNA进行全外显子测序来测定。
EGFR/ALK野生型肺癌:是指在肺癌中检测结果显示没有EGFR基因突变或ALK基因融合的状态。EGFR和ALK都是常见的具有致癌作用的基因,其异常活化与一些非小细胞肺癌的发生相关联。
培美曲塞:是一种通过抑制PD-1免疫检查点而实现增强免疫反应的人源化单克隆抗体,常用于多种恶性肿瘤的治疗。
3期研究:是在经过前期实验室及临床研究验证后,为了最终确认药物的安全性、有效性等关键问题而进行的大规模、多中心、较长时间的临床试验。
META analysis:利用统计学方法,对已经发表的相关研究结果进行整合和综合分析,从而得出更为可靠的结论。Meta分析可以帮助梳理现有证据,评估治疗效果或风险因素,发掘潜在的影响因素,指导临床实践和公共卫生决策。)
风险比 (RR) 和风险比率 (HR):RR和HR都是流行病学和临床试验中常用的度量指标,用于评估某种暴露或治疗对某种结果发生率的影响。
1. 什么是晚期非小细胞肺癌?
它目前有哪些治疗手段?
晚期非小细胞肺癌是指非小细胞肺癌类型的肺癌已经扩散到身体其他部位(如淋巴结、骨骼、肝脏和大脑等)的阶段。这种类型的肺癌通常被分为第三和第四期,其治疗难度较大,预后也相对较差。晚期非小细胞肺癌的症状包括咳嗽、痰中带血、呼吸急促、胸痛、食欲减退、体重下降等。治疗方案主要包括化疗、放疗、靶向治疗和免疫治疗等,具体治疗方案应根据患者的具体情况和医生的建议而定。化学治疗是一种使用药物杀死或控制癌细胞生长的治疗方法,它可以通过口服、注射或静脉输注等方式进行。放疗是利用高能量射线杀死癌细胞的方法,该方法通常用于减轻症状或缩小肿瘤。免疫治疗是针对癌细胞特定的蛋白质或基因进行治疗,旨在抑制癌细胞生长和扩散。
2. 为什么我们要强调肺癌的免疫治疗?
大多数肺癌患者接受化疗和/或放疗,但这些治疗的抗肿瘤效果不佳。近年来,一些临床试验在PD-1/PD-L1和CTLA-4抗体治疗肺癌方面取得了令人满意的结果,其中帕博利珠单抗和纳武利尤单抗可延长晚期NSCLC患者的生存期,durvalumab联合化疗可有效改善广泛期NSCLC患者的预后。而且免疫治疗是新诊断出的总体状况良好且无禁忌证的晚期非小细胞肺癌患者的新治疗标准。
3.为什么联合免疫治疗很重要?
单免疫治疗仅显著延长了PD-L1高表达患者的生存期,这仅对少数患者有益。通过协同或联合治疗,可以以副作用增加为代价获得更大的治疗效果。最近的临床试验表明,双检查点抑制剂伊匹单抗联合纳武利尤单抗可以通过不同的互补机制协同增强T细胞功能和免疫系统对抗肿瘤细胞的能力,并且比纳武利尤单抗单药治疗具有更好的疗效。在PD-L1高的患者中效果更好,并且降低了晚期肿瘤患者的比例。
4. 那么何时适合联合免疫治疗?
关于何时使用联合治疗,有研究提示,肿瘤体积大的患者应接受免疫治疗联合其他治疗,以产生更强和更长期的疗效,而肿瘤体积小或PD-L1肿瘤比例评分极高的患者应接受免疫单药治疗。对于PD-L1表达阴性的肺癌患者,在治疗早期的短时间化疗中可释放肿瘤抗原。此时采用双重免疫疗法激活患者自身免疫系统,既增强了免疫治疗效果,又避免了长期化疗副作用的积累。然而,无论PD-L1表达水平如何、肿瘤突变负荷(TMB)高的NSCLC患者,PD-L/PD-L1联合CTLA-4抑制剂的PFS均显著超过化疗。还需要进一步的试验来探索基于生物标志物的免疫治疗方案的选择。
5. 关注疗效的同时也需注意不良反应
免疫相关不良事件(irAEs)不同于化疗相关毒性反应,是由免疫系统上调导致的严重炎症反应和免疫毒性,一些试验观察到严重不良反应并已停止。
目前已有多项临床试验评估PD-1/PD-L1联合CTLA-4抗体治疗晚期肺癌患者的疗效和不良反应,无进展生存期(PFS)和总生存期(OS)等结果存在争议,但总体毒性以及不良反应安全可控。
6. 与其他免疫疗法相比,PD-L1和CTLA-4抑制剂优势是什么?
晚期非小细胞肺癌患者的免疫治疗方案正以前所未有的速度增加,有望延长这种致命疾病的生存期。为了使应答最大化并使更大比例的患者获益,免疫治疗联合策略目前正在研究中,化学免疫疗法已经在使用。程序性死亡受体-1/配体-1 (PD-1/L1)和细胞毒性T淋巴细胞抗原-4 (CTLA-4)的组合是基于靶向参与T细胞活化的互补通路的原理开发的,并且已经显示在其他恶性肿瘤中具有高度活性。最近,3期POSEIDON试验表明,在未经治疗的晚期NSCLC患者中,Durvalumab联合Tremelimumab可带来生存获益。
7. D+T疗法是什么?
7.1 Durvalumab
Durvalumab是一种抑制PD-L1与PD-1结合的IgG1κ单克隆抗体,可阻断PD-L1与PD-1和CD80.12。在局部晚期NSCLC患者中,确定性放化疗后给予Durvalumab有无进展和OS获益。2018年3月,Imfinzi(durvalumab)被美国食品药品监督管理局(FDA)正式批准用于治疗不可切除的Ⅲ期非小细胞肺癌(NSCLC)患者。
7.2Tremelimumab
Tremelimumab是一种靶向细胞毒性T淋巴细胞相关抗原4 (CTLA-4)的人免疫球蛋白G2单克隆抗体。可阻断抑制性CTLA-4受体与B7.1和B7.2配体的结合,否则这些结合会激活通过CD28受体发挥作用的T细胞。有限的早期疗程tremelimumab可使T细胞应答多样化,并导致肿瘤浸润增加,而持续的durvalumab治疗可能增强t细胞功能,支持持续的抗肿瘤应答。2022年11月10日, FDA批准了tremelimumab和durvalumab以及铂类为基础的化疗用于具有EGFR突变或ALK改变(EGFR/ALK野生型)的转移性非小细胞肺癌(NSCLC)成人患者。
7.3 为何选择Durvalumab联合Tremelimumab治疗?
鉴于两者的作用机制互补,在基于durvalumab的治疗方案基础上加用tremelimumab预计将扩大临床活性,有可能通过实现新的T细胞应答,克服对PD-(L)1阻滞剂的原发性耐药。同时加用化疗会导致肿瘤细胞(TC)死亡和新抗原释放,这可能会增加免疫启动,并且根据临床经验,对于疾病的早期控制可能很重要。
Tremelimumab与durvalumab联合治疗已在多种情况下进行过评估,包括一线转移性NSCLC。
8. D+T疗法—来自代表性的临床研究
8.1 The Phase III POSEIDON Study
POSEIDON是一项3期、全球性、随机、开放标签研究,采用三组设计,评估了tremelimumab + durvalumab和化疗(T + D + CT)以及durvalumab +化疗(D + CT)与单独化疗(CT)相比在一线mNSCLC中的疗效。在抗pd - L1和化疗的基础上加用有限疗程的抗ctla -4为一线EGFR/ALK野生型mNSCLC常用治疗策略的长期疗效和耐受性提供了见解。研究者在本文中报告了主要和次要分析的结果。
8.1.1 主要研究方案
EGFR/ALK野生型mNSCLC患者(n = 1,013)被随机分组(1∶1∶1),接受tremelimumab 75 mg + durvalumab 1,500 mg和铂类化疗,最长4个周期,21日为1个周期,之后每4周1次durvalumab治疗,直至疾病进展,并接受1次额外tremelimumab剂量。Durvalumab +化疗最多4个周期,每个周期21日,之后每4周1次Durvalumab,直至疾病进展。或长达6个21天周期的化疗(联用或不联用培美曲塞维持治疗)。主要终点是D + CT组与CT组相比的无进展生存期(PFS)和总生存期(OS)。关键α控制的次要终点是T + D + CT与CT相比的PFS和OS。
8.1.2 研究结果
与常规治疗相比,D + CT治疗显著改善了PFS(风险比[HR],0.74;95% CI, 0.62 ~ 0.89;P = 0.0009;中位时间分别为5.5个月和4.8个月),OS改善趋势未达到统计学显著性(风险比[HR],0.86;95% CI, 0.72 ~ 1.02;中位时间13.3个月VS 11.7个月;24个月OS分别为29.6%和22.1%)。PFS (HR, 0.72;95% CI, 0.60 ~ 0.86;中位时间,6.2个月vs 4.8个月)和OS(HR,0.77;95% CI, 0.65 ~ 0.92;中位随访时间14.0个月和11.7个月;24个月OS分别为32.9%和22.1%)显著改善。T + D + CT组、D + CT组和CT组的3 ~ 4级不良事件发生率分别为51.8%、44.6%和44.4%;分别有15.5%、14.1%和9.9%的患者因治疗相关不良事件停止治疗。
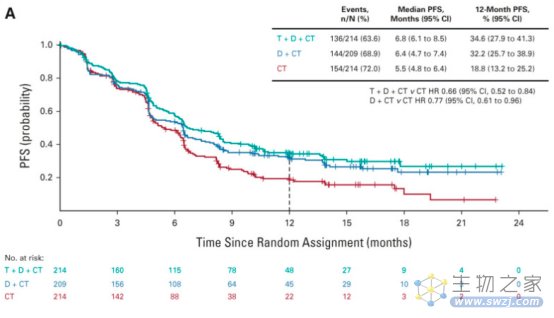
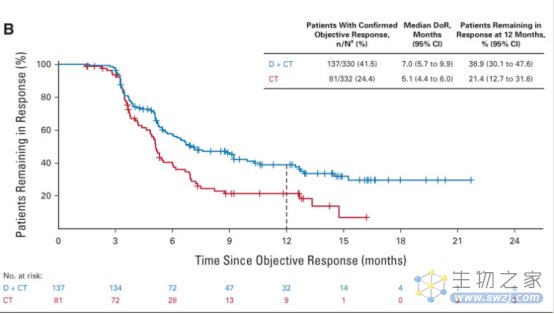
8.1.3 研究结论
与CT相比,D + CT显著改善了PFS。与CT相比,在durvalumab和化疗的基础上加用有限疗程的tremelimumab显著改善了OS和PFS,且未增加有意义的耐受性负担,这代表了一线mNSCLC的潜在新选择。
8.2 A meta-analysis
按照检索策略,研究者检索电子数据库,查找检测肺癌患者PD-1/PD-L1联合CTLA-4抗体的随机对照试验;采用随机效应模型或固定效应模型计算RR[客观缓解率(ORR)、总生存期(OS)、无进展生存期(PFS)和免疫相关不良事件(irAEs)]并进行合并,采用Review Manager 5.3和Stata 15.1软件进行异质性分析和发表偏倚分析。
8.2.1 研究结果
研究共纳入6项研究。使用了4种不同的免疫检查点抑制剂(纳武利尤单抗、帕博利珠单抗、durvalumab、tremelimumab)。对于晚期肺癌,双检查点抑制剂±其他疗法使ORR显著改善(RR 1.49, 95% CI 1.11 ~ 1.98)、OS (HR 0.72, 95% CI 0.63 ~ 0.83)和PFS (HR 0.72, 95% CI 0.63 ~ 0.82)。亚组分析与合并结果一致。PD-L1≥1% (HR 0.67, 95% CI 0.54 ~ 0.82)亚组差异提示亚组效应有统计学意义,但PD-L1 <1%亚组(HR 0.88, 95% CI 0.75 ~ 1.05)差异无统计学意义。≥3级不良事件发生率低于对照组(RR 0.90, 95% CI 0.80 ~ 1.02),但差异无统计学意义。
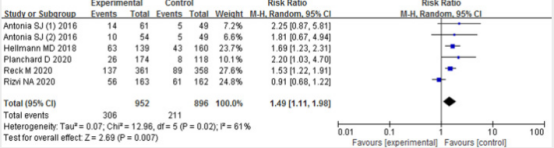
8.2.2研究结论
PD-1/PD-L1抑制剂联合CTLA-4抑制剂可改善晚期或转移性肺癌患者的ORR和PFS,但不良反应发生率较高,虽然总体可耐受。SCLC患者的生存期短于NSCLC患者,且治疗选择有限。双重免疫抑制剂对SCLC也有治疗作用。PD-1/PD-L1联合CTLA-4抑制剂可能是晚期肺癌患者的一种有前景的治疗策略,但应注意不良反应的发生。
9. 总结与未来的展望
在durvalumab和化疗的基础上加用有限疗程的tremelimumab为mNSCLC患者带来了长期生存获益,并且早期疾病得到控制,耐受性可控,而不影响治疗暴露。总的来说,抗CTLA-4的加入扩大了PD-L1 TC和lt患者的临床获益。早期数据提示,不论PD-L1表达情况如何,durvalumab与CTLA-4抑制剂tremelimumab联用均具有良好的活性,并且durvalumab可能与其他药物(如铂类双药化疗)联用。然而,与联合用药相关的治疗相关毒性是决策过程中获益-风险评估的一个重要方面。来自现实研究的数据有助于更好地评估durvalumab-tremelimumab联合治疗在特定癌症亚群中的临床应用价值,并希望根据生物标志物对患者进行更好的分类,以帮助识别良好的反应者和真正获得预后获益的患者。































