终于熬到周末,原本满心欢喜地想着一定要睡个美美的懒觉,可一到平时起床的点儿——居然醒了?!……这种令人抓狂的经历,想必大家都有过吧!
其实,不论是被老人家们津津乐道的养身法宝之“日出而作、日落而息”,还是网上充斥着的各类熬夜、通宵、“倒时差”小妙招,其实都是通过形成一种具有节律性的生命活动规律,使我们更好地适应符合当下的日夜交替。通俗地来说,就是自发调整“生物钟”(Circadian Clock)。

这台能够调节我们日常休眠-觉醒周期的内部时钟,其实不仅仅存在于动植物体内,就连微生物也拥有一套属于自己的“昼夜节律”。但一旦这种节律发生异常,睡眠障碍、代谢紊乱和免疫力下降等症状就会接踵而至;更有研究指出,糖尿病、抑郁症、肿瘤等重大疾病也与其有着千丝万缕的关系。
那所谓的“生物钟”到底长什么样呢?难道真的如同我们日常的表盘一样,还有齿轮和指针?
相信大家伙儿都和我一样,直觉上总认为生物钟应该就是一种没有实体的生理状态而已——但真相可并非如此。
就在前几天,来自军事医学研究院的李慧艳研究员团队协同张学敏院士团队合作发表了一篇论文。文章指出,SCN神经元的初级纤毛就是调控机体节律的细胞器——换言之,“钟”被找到了!这一发现无疑将此前充满玄幻色彩的“无形”生物钟化为了“有形”。2023年6月1日,相关研究成果以“Rhythmic Cilia Changes Support SCN Neuron Coherence in Circadian Clock”为题,在线刊登于《科学》(Science)。
Rhythmic cilia changes support SCN neuron coherence in circadian clock(Source: Science)
脑视交叉上核(suprachiasmatic nucleus,SCN)是已知的“生物钟”指挥中枢,其中包含了大约20,000个神经元的异质性群体,大多数可以单独产生自主的昼夜节律振荡。放大这些神经元,可以在其细胞膜表面观察到一根伸出的“天线”,即此前提到的“初级纤毛”(primary cilia,PC)。初级纤毛其貌不扬,但却存在于几乎所有哺乳动物的细胞表面,对信号的接受和传递以及细胞的运动起着至关重要的作用。一旦发生缺陷,就会导致譬如脑畸形、生育障碍、骨骼异常等可怕的“纤毛病”(ciliopathy)。
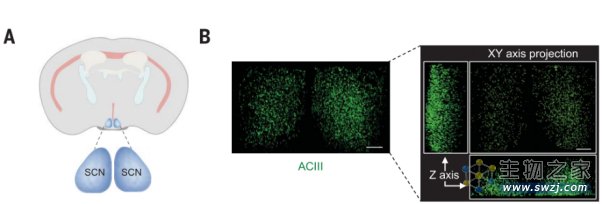
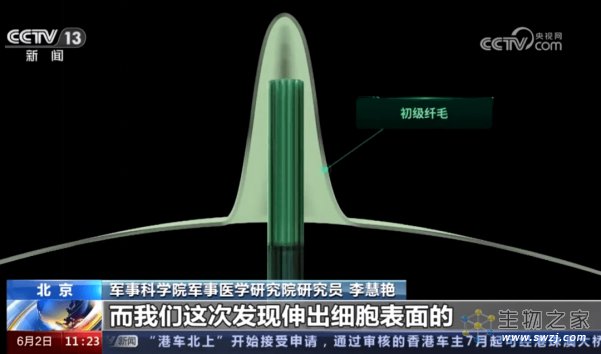
初级纤毛的分布及模型图(Source: Science,央视新闻)
通过脑切片染色以及20x成像,初级纤毛在小鼠大脑中的分布清晰地显现出来。
由于SCN是昼夜节律重要的调节中枢,研究人员对SCN神经元的初级纤毛进行了测试,观察它们是否会由于光的影响而表现出振荡节律。结合后续的动物实验,他们惊喜地发现了一个特别有趣的现象:SCN中占比90%的NMS神经元(neuromedin S–producing neurons),其表面的纤毛居然会发生明显的昼夜节律性变化——每24小时内,该结构长度就会产生一次由“极长”至“极短”的伸缩现象!
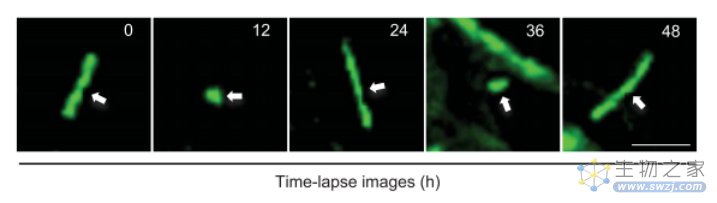
48小时内,SCN神经元初级纤毛的代表性延时图像(Source: Science)
在动物实验中,不同状态的小鼠被分别置于明-暗交替(Light-Dark,LD)和持续黑暗(Dark-Dark,DD)的环境中。
第一轮观察结果显示,在LD循环下,作为对照组的正常野生型小鼠和SCN纤毛特异性缺陷小鼠(SCNcilia-null mice)在24小时的活动内均表现正常;在DD循环下,SCN纤毛特异性缺陷小鼠的周期也仅仅是略微延长。
紧接着,研究人员展开了第二轮观察——让这两种小鼠也体验一把“倒时差”的感觉!最终, SCN纤毛特异性缺陷小鼠不负众望,仅用了1-3天,就适应了新的时间周期,而正常小鼠则花费了9-11天才调整好状态。
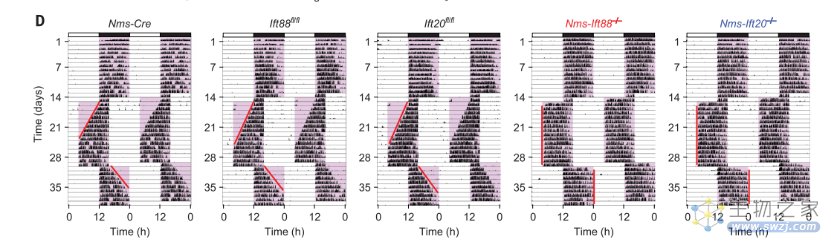
小鼠在实验时差条件下的代表性双标绘行为图(Source: Science)
研究人员还指出,纤毛还具有“调控”节律的作用——即通过“团结”SCN神经元,将机体内的昼夜节律进行统一。实验中,纤毛特异性缺陷小鼠的SCN神经元间的通讯能力明显降低,这使得理想中的细胞间同频共振最终无法得以实现。
除此之外,考虑到SCN中的细胞耦合与抵抗外界温度变化有关,而纤毛特异性缺陷小鼠对周期性温度变化的抗干扰能力却表现不佳,因此研究人员认为,初级纤毛或还有助于SCN神经元间的耦合,也许从某种程度上来说,生物钟对于温度变化的抗性很有可能就是来自于纤毛依赖的耦合现象。
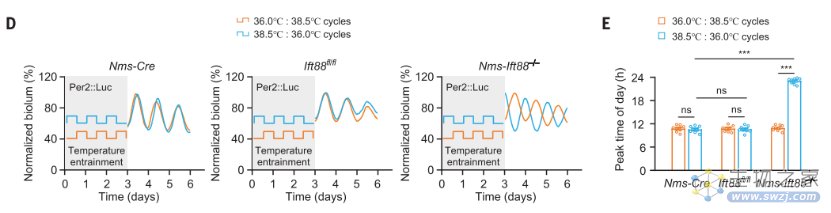
纤毛特异性缺陷小鼠对于循环温度的抵抗能力表现不佳(Source: Science)
现下,生物钟的重要“指针”已经被找到——小白鼠们都可以白天睡觉、晚上干活儿了!未来,针对咱们个性化的“调表”业务,还会远吗?
参考文献:
Science: Rhythmic cilia changes support SCN neuron coherence in circadian clock
DOI: 10.1126/science.abm1962































