BPDCN最先发生在那些经常被晒的部位,如头顶,并且这些肿瘤带有因紫外线辐射诱发产生的新突变。紫外线诱导的损伤先于恶性转化,在皮肤中发生恶性转化的BPDCN细胞可以扩散到其他部位,包括以前未受累的骨髓,并可能导致皮肤癌复发。
紫外线会成为一种罕见急性白血病的推手。
当地时间6月7日,《自然》(Nature)杂志在线刊登的一项研究显示,原始浆细胞样树突细胞肿瘤(BPDCN)起源于骨髓中的克隆(癌前)造血前体,紫外线辐射会诱导BPDCN癌前细胞的进化,进而导致BPDCN的发生。
该研究由美国麻省理工学院和哈佛大学博德研究所(Broad Institute of MIT and Harvard)加布里埃尔·格里芬(Gabriel K. Griffin)等人,以及丹娜—法伯癌症研究所(Dana-Farber Cancer Institute)、布莱根妇女医院(Brigham and Women’s Hospital)等研究机构的研究人员共同完成。
原始浆细胞样树突细胞肿瘤(BPDCN)是一种罕见的急性白血病形式,常以皮肤受损为首发症状,可呈现挫伤样,部分形成溃疡,随病情进展可累及骨髓、淋巴结、其他软组织、中枢神经系统等。
BPDCN于1994年被首次报道,迄今为止全球共有200多例报道,国内尚无流行病学数据。该疾病诊断时间较长,但进展迅速,且预后不良。有研究显示,BPDCN症状出现至诊断的中位时间为6个月,最长可达1.5年,复发后常出现耐药,患者中位生存期为12-16个月。目前,BPDCN的发病机制不详。
BPDCN起源于骨髓中的造血克隆前体
由一个祖先细胞产生的细胞群称为克隆,科学家们已经发现,携带突变的细胞克隆的生长(扩增)在正常组织中很普遍,这被称为“体细胞镶嵌”。大多数克隆不会进展为恶性疾病,但少数细胞会发生额外的改变,在局部组织环境中获得增殖或存活的优势。
BPDCN常与潜在的克隆性造血相关,克隆性造血是指造血干细胞分化为各系成熟细胞的过程,这些成熟血细胞通常会发生遗传学异常。一般认为,从克隆性造血到白血病的转变发生在骨髓中,此时特定基因可能会进一步突变,导致肿瘤抑制基因的缺陷或产生增加恶性细胞存活率的突变组合。癌症疗法、烟草烟雾等外在因素可能会促进携带特定突变的克隆的生长。
为确定骨髓中癌前克隆与BPDCN之间的关系,格里芬团队招募了16名BPDCN患者,包括9名没有骨髓受累的患者,7名皮肤和骨髓同时受累的患者,并使用全基因组测序、单细胞RNA测序和单细胞DNA测序等一系列基因组学方法对他们的疾病进展过程进行了分析。
对骨髓受累样本的靶向测序显示,16名患者中有15名存在致病突变,这些突变涉及TET2(11名患者),ASXL1(9名患者)和RNA剪接因子(9名患者)。进一步分析显示,骨髓是BPDCN癌前克隆的来源。此外他们还发现,近70%的BPDCN病例存在TET2突变,大约10%的BPDCN病例存在IDH2热点突变。这表明TET2失活在BPDCN发展过程中的独特作用。
格里芬团队的系统发育分析表明,BPDCN起源于骨髓中克隆扩增的祖细胞,整合的单细胞RNA测序和基因分型分析验证了这一点。他们还发现,在骨髓受累的样本中,免疫细胞的分化倾向于产生浆细胞样树突状细胞(pDC)。随后格里芬团队提出了一种模型,克隆(癌前)造血前体产生一系列分化血细胞群,包括pDC,这些pDC细胞在转化为恶性BPDCN的过程中发生了额外的突变。
为验证该模型,格里芬团队分析了来自健康供体和BPDCN患者骨髓样本的pDC突变。单细胞转录和突变分析表明,骨髓受累的样本具有更显著的BPDCN特征以及突变负担。相比之下,在没有骨髓受累的样本中,pDC突变负担较低。
紫外线促进癌前pDC生长
接着,格里芬团队评估了癌症体细胞突变目录(COSMIC)中定义的30个突变特征的基因组测序数据(WES和WGS),发现7名BPDCN患者中有4名具有显著的紫外线辐射相关特征,他们还在另外21个BPDCN样本中检测到10个具有紫外线特征的样本。
进一步分析发现,BPDCN最先发生在那些经常被晒的部位,如头顶,并且这些肿瘤带有因紫外线辐射诱发产生的新突变。紫外线诱导的损伤先于恶性转化,皮肤中的癌前pDC或pDC样细胞在许多情况下是BPDCN的“前身”。在皮肤中发生恶性转化的BPDCN细胞可以扩散到其他部位,包括以前未受累的骨髓,并可能导致皮肤癌复发。
不过,紫外线诱导的DNA损伤并没有直接导致与BPDCN相关的突变,而是促进癌前pDC的生长。通过在实验室中培养癌细胞,格里芬团队将分化细胞暴露于紫外线辐射下,观察到细胞死亡随着紫外线剂量增加而增加。携带TET2突变的pDC细胞比正常pDC细胞更能抵抗紫外线诱导的细胞死亡,这表明TET2在暴露于紫外线的pDC中具有肿瘤抑制作用。
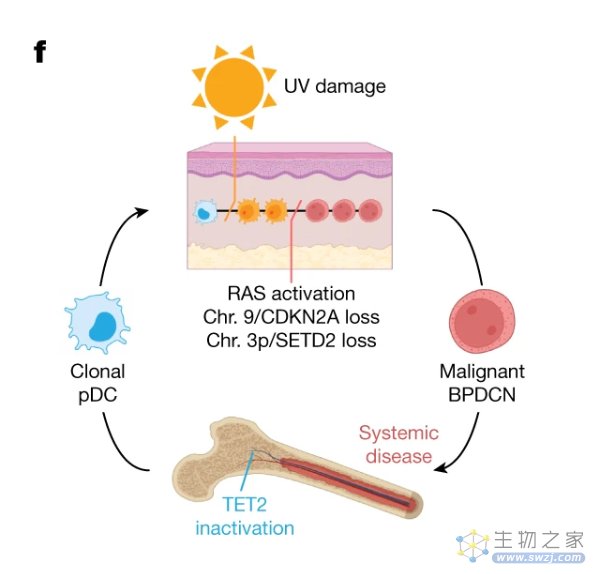
紫外线促进BPDCN癌前细胞发展为BPDCN的模型示意图。图片来源:格里芬团队论文
格里芬团队认为,其研究证据表明,BPDCN中TET2失活、皮肤定位和紫外线相关突变之间存在很强的关联,至少部分解释了为什么TET2通路中的突变与BPDCN相关。
“未来的研究领域包括确定TET2如何影响DNA损伤反应,以及紫外线突变是否会产生可能对免疫疗法敏感的新抗原。”格里芬团队在论文中写道。
他们还表示,虽然BPDCN是一种相对罕见的疾病,但研究血液系统癌前细胞如何受紫外线影响而发生早期演变的模型,或许也适用于一些其他类型的白血病。
《自然》杂志同日发布的一篇评论文章评价道:“作者的发现证明了组织特异性环境如何驱动癌前克隆的进化,形成一种可以影响局部(如皮肤),并扩散到其他(骨髓)部位的癌症。随着体细胞镶嵌普遍性的证据越来越多,有必要进一步研究遗传突变、体细胞嵌合体、塑造细胞存活的因素之间的相互作用,以及正如格里芬等人所强调的那样,器官特异性突变在克隆细胞谱系引起的疾病进化中的作用。”
参考资料:
1. https://www.nature.com/articles/s41586-023-06156-8
2. https://www.nature.com/articles/d41586-023-01815-2
3. 王莹, 姚浩, 白海. 母细胞性浆细胞样树突状细胞肿瘤发病机制,诊断和治疗的研究进展[J]. 现代肿瘤医学 2022年30卷4期, 709-713页































