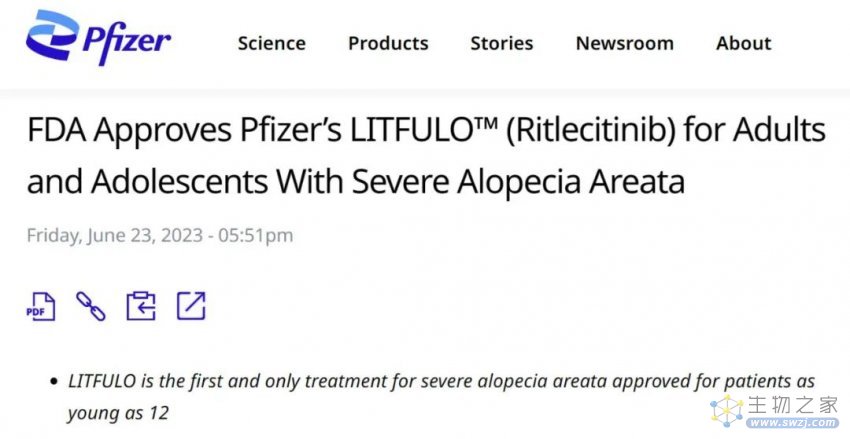
美国当地时间6月23日,辉瑞公司宣布,美国食品和药物管理局(FDA)已批准其双激酶抑制剂Litfulo(ritlecitinib/利特昔替尼)上市,推荐剂量为50毫克。这是FDA批准的第一个可用于患有严重斑秃的青少年(12+)的治疗方法。此前一年,2022年6月,FDA批准了礼来JAK抑制剂baricitinib(Olumiant/巴瑞替尼)口服片剂用于治疗严重斑秃,不过适用人群为成年患者。
两款药都为每日口服一次。
可恢复80%头发生长
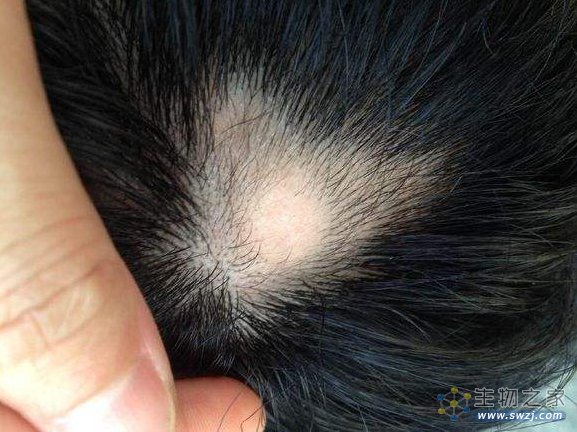
斑秃是全球发病率第二高的脱发症,世界上大约有1.47亿斑秃患者,中国患者约有400万。斑秃是一种自身免疫性疾病,由于免疫系统攻击毛囊,导致患者头皮、脸部或身体其他部分的毛发部分或完全脱落,斑秃症状经常在儿童时期就会首次发作,任何年龄、性别和种族的人群都可能患上斑秃。该疾病严重影响患者外在形象美观,会对患者的心理健康和生活质量产生负面影响。
Litfulo(ritlecitinib/利特昔替尼)是辉瑞开发的一款新型口服共价双激酶抑制剂,其对JAK3激酶以及在TEC家族中的酪氨酸激酶具有高度选择性,能够抑制 IL-15 和 CD8 细胞因子信号转导,这两个细胞因子是驱动免疫系统杀伤毛囊细胞的重要因素。
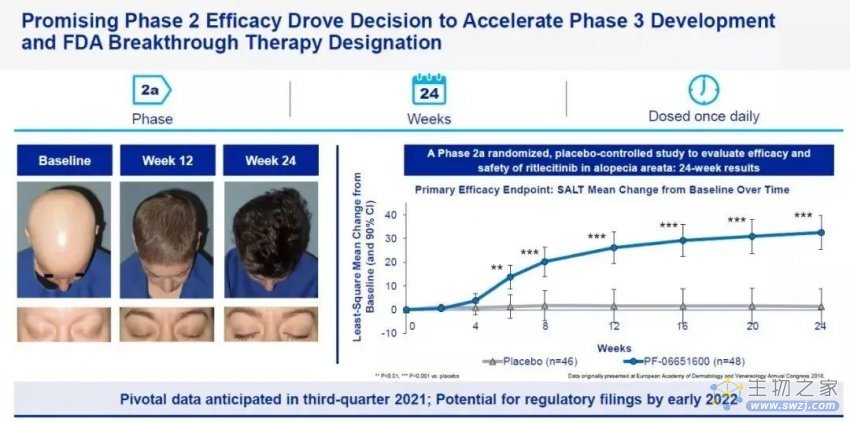
此次获批基于Litfulo(ritlecitinib/利特昔替尼) 临床2b/3期试验ALLEGRO的研究,该研究在18个国家和地区共118家研究中心评估Litfulo疗效和安全性。共入组718例斑秃患者,这些患者至少有50%的头发因斑秃而脱落,研究结果显示,23%接受50mg Litfulo治疗的患者在6个月后头皮毛发覆盖达80%或以上(SALT≤20),而此数值在安慰剂组仅为1.6%,青少年(12-17岁)和成人(18岁及以上)使用Litfulo的疗效和安全性一致,同时,药物安全性与耐药性良好,最常见的不良反应为头痛、鼻咽炎与上呼吸道感染。
国内相关进展
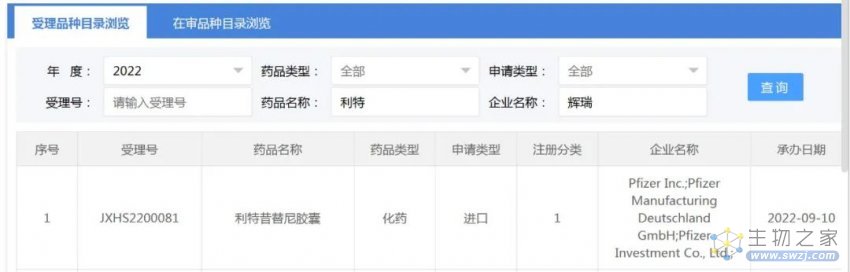
查询国家药监局药品审评中心(CDE)官网信息显示,2022年9月10日,CDE受理了辉瑞Litfulo(ritlecitinib/利特昔替尼)的注册申请。
不过,礼来制药的巴瑞替尼(商品名:艾乐明)同样在国内快其一步。2023年3月27日,礼来制药宣布,其口服JAK抑制剂巴瑞替尼(商品名:艾乐明)获得国家药监局批准,用于成人重度斑秃的系统性治疗,这也是国内首个获批用于系统性治疗重度斑秃的创新靶向药物。
此外,国内还有多家企业正开展相关适应症的研究,恒瑞医药子公司瑞石生物的JAK1抑制剂SHR0302片和泽璟制药的JAK1/2/3抑制剂杰克替尼都处在III期临床研究阶段,科伦博泰A223根据其最新发布的港交所招股书显示,该款在研药品目前处于临床II期。
值得一提的是,Litfulo(ritlecitinib/利特昔替尼)除上述斑秃适应症外,2023年4月,该款药品还被纳入国家药监局突破性治疗品种,针对适应症为:适合系统性治疗的非节段型白癜风患者(≥12岁)。
































