
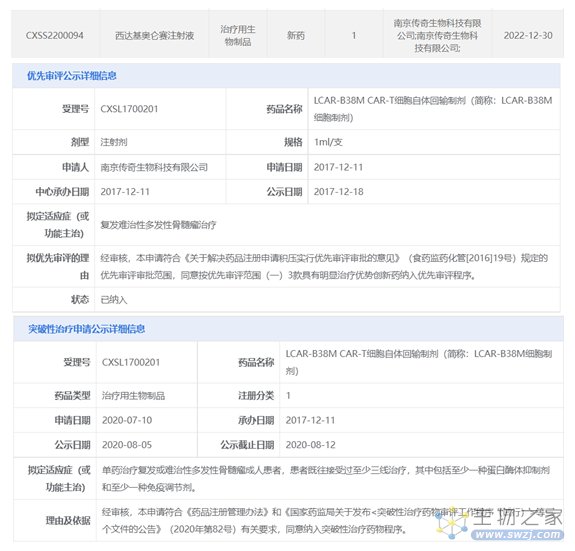
2022年12月30日,中国国家药监局药品审评中心(CDE)官网公示,南京传奇生物科技有限公司递交了治疗用生物制品1类新药西达基奥仑赛注射液的上市申请并获得受理。公开资料显示,西达基奥仑赛(英文通用名Ciltacabtagene Autoleucel,简称Cilta-cel)是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体T细胞(CAR-T)疗法,2017年12月18日被纳入优先审评,适用于复发难治性多发性骨髓瘤治疗。2020年8月5日被纳入突破性治疗品种,这是中国首个获得“突破性疗法”的CAR-T疗法。
图片来源:CDE官网
01
关于多发性骨髓瘤(MM)
多发性骨髓瘤是一种无法治愈的血癌,起源于骨髓,以浆细胞增殖过度为特征。据统计,2020年欧洲有超过50,900人被诊断患有多发性骨髓瘤,约32,500名患者死亡。在日本,2018年约有7800人被诊断出患有多发性骨髓瘤,2020年约有4200名患者死亡。到2022年,预计美国将有超过34,000人被诊断出患有多发性骨髓瘤,超过 12,000人将因此死亡。虽然一些多发性骨髓瘤患者无明显症状,但大多数患者是由于骨骼问题、血细胞计数低、钙升高、肾脏问题或感染等症状而被确诊。尽管经过治疗可能会有一些缓解,但不幸的是,患者很可能会复发。接受标准疗法(包括蛋白酶抑制剂、免疫调节剂和抗CD38单克隆抗体)治疗后复发的患者会面临预后不佳,治疗手段受限的问题。
02
关于CARVYKTI®(西达基奥仑赛)
西达基奥仑赛是一种嵌合抗原受体T细胞(CAR-T)疗法,在美国和欧洲之前被称为JNJ4528,而在中国则被称为LCAR-B38M细胞疗法。
CARVYKTI®是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体T细胞(CAR-T)疗法,使用嵌合抗原受体(CAR)的转基因对患者自身的T细胞进行修饰,以识别和消除表达BCMA的细胞。BCMA主要表达于恶性多发性骨髓瘤B细胞、晚期B细胞和浆细胞的表面。CARVYKTI®的CAR蛋白具有两种BCMA靶向单域抗体(包含一个4-1BB共刺激结构域和两个BCMA靶向单域抗体),对表达BCMA的细胞具有高亲和力,在与BCMA表达细胞结合后,CAR可促进T细胞活化、扩增,继而清除靶细胞。CARVYKTI®以具有两种靶向B细胞成熟抗原(BCMA)单域抗体、个性化定制、一次性回输的给药方式为特色,推荐剂量为每公斤体重0.5~1.0×106个CAR-T细胞。
CARVYKTI®于2019年12月在美国和2020年8月在中国获得突破性疗法认定。此外,CARVYKTI®于2019年4月获得欧盟委员会优先药物资格认定,于2021年5月获得美国优先审评。美国FDA、欧洲EMA和日本PMDA分别于2019年2月、2020年2月及2020年6月授予CARVYKTI®孤儿药资格认定。2022年5 月,欧洲药品管理局的孤儿药品委员会一致建议,根据临床数据(治疗后完全缓解率有所改善且持续存在)维持CARVYKTI®的孤儿药认定。
2022年ASH年会上,传奇生物展示了CARVYKTI®的壁报结果(摘要号:Poster 3354,CARVYKTI®用于首次治疗后早期复发的多发性骨髓瘤患者:CARTITUDE-2队列B(NCT04133636)的18个月随访结果)。截至2022年6月1日,19例患者接受了CARVYKTI®治疗,16例仍在接受治疗中。中位随访时间为17.8个月(5.2~26.3)。79%的患者既往接受过ASCT。总缓解率为100%,100%达到VGPR或更好的缓解,90%达到CR或更好的缓解。至首次缓解和最佳缓解的中位时间分别为0.95个月(0.9~9.7)和5.1个月(0.9~11.8)。在MRD可评价的患者(n=15)中,14例(93%)在研究期间达到MRD 10-5阴性。未达到中位DOR,12个月无事件率为84%。12个月无进展生存率为90%。
最常见的治疗中出现的AE为血液学事件(3/4级:中性粒细胞减少,淋巴细胞减少,血小板减少,白细胞减少)。从CARVYKTI®输注至发生CRS的中位时间为8天(5~11天),发生于16例(84.2%)患者。所有患者的CRS均消退。1例患者发生ICANS(1级),1例患者发生运动和神经认知TEAE/帕金森综合征(3级)(既往报告)。3例患者在CARVYKTI®后第158、417和451天死于疾病进展。
总体而言,在这一功能性高风险患者群体中,所有患者在接受标准护理前期治疗的一年内复发(包括79%的ASCT患者),90%的患者在CARVYKTI®输注后1年内保持疾病无进展。
03
研发进展
日本上市
2021年12月6日,杨森制药有限公司(Janssen)向日本厚生劳动省(MHLW)提交西达基奥仑赛的新药申请(NDA)。
2022年9月27日,日本厚生劳动省 (MHLW)已批准CARVYKTI®(西达基奥仑赛,英文通用名Ciltacabtagene Autoleucel,简称Cilta-cel)用于治疗复发或难治性多发性骨髓瘤(R/R MM)成人患者,仅限符合以下两项条件:
患者无靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)阳性T细胞输注治疗史;
患者既往接受过至少三线治疗,包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38单克隆抗体,且对末次治疗无响应或已复发。
此次批准是基于关键性1b/2期CARTITUDE-1(NCT03548207)研究结果,该研究纳入了97位既往接受过中位六线治疗(范围3-18),包括PI、IMiD和抗CD38单抗的患者。研究显示,接受西达基奥仑赛一次性治疗的非日本人群显现了深度持久的缓解,总缓解率(ORR)达96.9%(95%CI,91.2-99.4 n=97)。值得注意的是,65名患者达到了严格意义上的完全缓解(sCR),严格意义上的完全缓解率达67%(95%CI,56.7-76.2),即治疗后无法通过影像学或其他检查观察到任何疾病体征或症状1。在多发性骨髓瘤日本患者中观察到的疗效与非日本人群一致2。在18个月的中位随访时间里,中位缓解持续时间(DOR)为21.8个月3。
1. 数据截至2020年9月1日,即对最后一名患者治疗后至少6个月。
2. 数据截至2021年7月22日,即对最后一名患者治疗至少12个月。
3. 该数据已在2021年美国临床肿瘤学会(ASCO)年会上发表。
CARTITUDE-1(NCT03548207)研究在106名成人患者中评估了西达基奥仑赛的安全性,包括97名非日本人群和9名日本患者。在接受西达基奥仑赛治疗的106名患者中,有105名(99.1%)患者出现了不良反应。最常见的不良反应包括细胞因子释放综合征(94.3%)、血细胞减少症(79.2%)、中性粒细胞减少症(75.5%)、血小板减少症(59.4%)、贫血(51.9%)、神经系统不良事件(39.6%)、感染(19.8%)和低丙球蛋白血症(11.3%)。
美国上市
CARVYKTI®于2022年2月28日获得FDA批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,这是首款中国自主原创并在美国上市的CAR-T细胞治疗产品。此次获批是主要基于关键性临床Ib/II期CARTITUDE-1 (NCT03548207) 研究结果。最新数据显示,Cilta-cel在既往接受过四线或者以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤患者中显示出高达98%的总缓解率。在关键的CARTITUDE-1 (NCT03548207) 研究中,97例R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%(95%CI:92.7-99.7),78%的患者获得了严格的完全缓解(sCR,95%CI:68.8-86.1)。在18个月的中位随访时间中,中位缓解持续时间(DOR)为21.8个月(95% CI,21.8-无法预估)。
CARVYKTI®只能通过风险评估和缓解策略(REMS)的受限给药计划(CARVYKTI®REMS)获取。CARVYKTI®的安全信息包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)、帕金森病和吉兰-巴雷综合征、嗜血细胞性淋巴组织增生症/巨噬细胞活化综合征(HLM/MAS)以及长期或复发性细胞减少症的黑框警告。警告和预防措施包括长期复发性细胞减少、感染、低丙种球蛋白血症、超敏反应、继发性恶性肿瘤、对驾驶和使用机器的能力的影响。最常见的不良反应(≥20%)为发热、CRS、低丙种球蛋白血症、低血压、肌肉骨骼疼痛、疲劳、不明病原体感染、咳嗽、寒战、腹泻、恶心、脑病、食欲下降、上呼吸道感染、头痛、心动过速、头晕、呼吸困难、水肿、病毒感染、凝血功能障碍、便秘和呕吐。
欧盟上市
2021年4月,传奇生物宣布向EMA提交上市许可申请,以寻求CARVYKTI®的获批, 用于治疗复发或难治性多发性骨髓瘤患者。2022年5月26日,欧盟EC授予CARVYKTI®附条件上市许可,此次获批主要基于关键性临床Ib/II期CARTITUDE-1 (NCT03548207) 研究结果。结果表明,CARVYKTI®在单次治疗复发或难治性多发性骨髓瘤患者中显示出高达98%的总缓解率 (ORR)。这项批准基于关键性CARTITUDE-1 (NCT03548207) 研究结果,该研究纳入了既往接受过中位六线治疗(范围3-18)包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38抗体的患者。结果显示,在中位随访18个月(范围1.5-30.5)中,97例接受西达基奥仑赛一次性治疗的R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%(95%CI:92.7-99.7)。值得注意的是,80%的患者达到了严格意义的完全缓解(sCR),即治疗后无法通过影像学或其他检查观察到任何疾病体征或症状的措施。
在两项入组的179名成人患者的开放标签临床试验(MMY2001(NCT03548207)和MMY2003(NCT04133636))中,评估了CARVYKTI®的安全性。最常见的不良反应 (≥20%) 为中性粒细胞减少症 (91%)、细胞因子释放综合征 (CRS) (88%)、发热 (88%)、血小板减少症 (73%)、贫血 (72%)、白细胞减少症 (54%)、淋巴细胞减少症 (45%)、肌肉骨骼疼痛 (43%)、低血压 (41%)、疲劳 (40%)、转氨酶升高(37%)、上呼吸道感染 (32%)、腹泻 (28%)、低钙血症 (27%)、低磷血症 (26%)、恶心 (26%)、头痛 (25%)、咳嗽 (25%)、心动过速 (23%)、发冷 (23%)、脑病 (22%)、食欲下降 (22%)、水肿 (22%) 和低钾血症(20%)。
03
权益合作
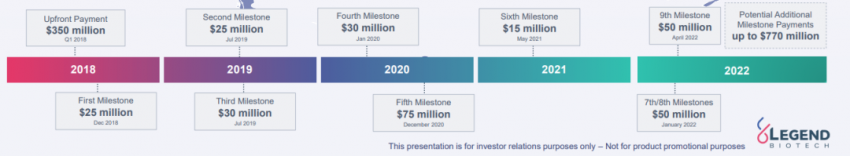
2017年6月,CARVYKTI®以100%的客观缓解率首次亮相ASCO。2017年12月22日,杨森与传奇生物签订了全球独家许可和合作协议,以开发和商业化西达基奥仑赛(Cilta-cel,传奇生物研发代号LCAR-B38M,杨森研发代号JNJ-4528)。根据协议,传奇生物将从杨森获得3.5亿美元的预付款,并有权在开发、生产、监管和销售方面达到里程碑进展时获得额外付款。该协议规定,在除大中华区以外的全球市场中,传奇生物和杨森公司的成本和利润分摊比例为50/50,在大中华区该分摊比例为70/30(传奇生物/杨森公司)。
2018年12月,根据与杨森的协议条款和条件,在美国实现了第一个临床里程碑,从而使得传奇生物获得了杨森的2500万美元里程碑付款。2019年7月,与美国临床试验相关的第二个和第三个里程碑已经实现,传奇生物从杨森获得5500万美元里程碑付款。2020年1月,传奇生物获得在美国临床开发相关的第四笔3000万美元里程碑付款。2020年12月,传奇生物获得在美国第五个临床7500万美元里程碑付款。2021年5月,传奇生物获得在美国第六个临床1500万美元里程碑付款。2022年1月,传奇生物获得在美国第七和八个临床5000万美元里程碑付款。2022年4月,传奇生物获得在美国第九个临床5000万美元里程碑付款。传奇生物于合作期间已获得合计3亿美元的里程碑付款。传奇生物潜在的额外里程碑付款高达7.7亿美元。
图片来源:传奇生物官网































