生物大分子除了具有传统结构生物学可以解析的有序部分,还经常伴随着高度无序性的区域,而后者被发现可以参与到凝聚相的形成(biomolecular condensation),是几乎所有无膜细胞器形成的基础。解析这些无膜细胞器的组装模式,对于理解其在重要生物学过程及疾病发生中的功能是极为重要的。然而由于大分子凝聚相组成的多样性、无序性和动态性,解析其分子组装基础尤其是在细胞原位水平的相互作用机制极其困难。近年来逐渐发展成熟的冷冻电子断层扫描成像技术(cryo-electron tomography, ET)结合冷冻聚焦离子束减薄技术(cryo-focused ion beam milling)、冷冻光电镜关联技术(cryo-correlative electron and light microscopy, CLEM),与经典的定量质谱学结合,使得相分离无膜细胞器在细胞原位水平的高分辨率可视化成为可能。
2023年4月27日,欧洲分子生物学实验室(EMBL)Julia Mahamid课题组的张潇洁博士和Mikhail M. Savitski课题组Sindhuja Sridharan博士等在Cell杂志发表了题为Molecular mechanisms of stress-induced reactivation in mumps virus condensates 的研究论文。该研究利用cryo-ET、质谱定量分析及细胞生物学方法,首次揭示了在宿主细胞处于应激状态时,持续性感染的腮腺炎病毒是如何通过其在宿主细胞内的复制工厂这一凝聚相来实现激活的分子机制。

该研究是由一个意外的发现引起的。在细胞响应外界压力(如氧化、热休克、渗透应激条件等)时可以在数分钟内快速形成一种典型的无膜细胞器即应激颗粒。研究人员在利用cryo-CLEM 及cryo-ET对细胞原位水平的应激颗粒进行电镜成像时,意外的多次观察到实验所使用的HeLa细胞内有成团存在的直径约20纳米的螺旋形纤维结构。经过近两年时间的生化分离尝试、结构解析(subtomogram averaging)及质谱分析,研究人员惊奇的发现细胞不知何时意外感染了腮腺炎病毒,而这些螺旋形纤维结构其实是病毒的核衣壳(表征病毒复制工厂的位置)。病毒持续地存在于HeLa细胞中,却对细胞的增殖速度没有可见的影响。而当细胞处于应激状态时,这些病毒的复制却被诱导上调。
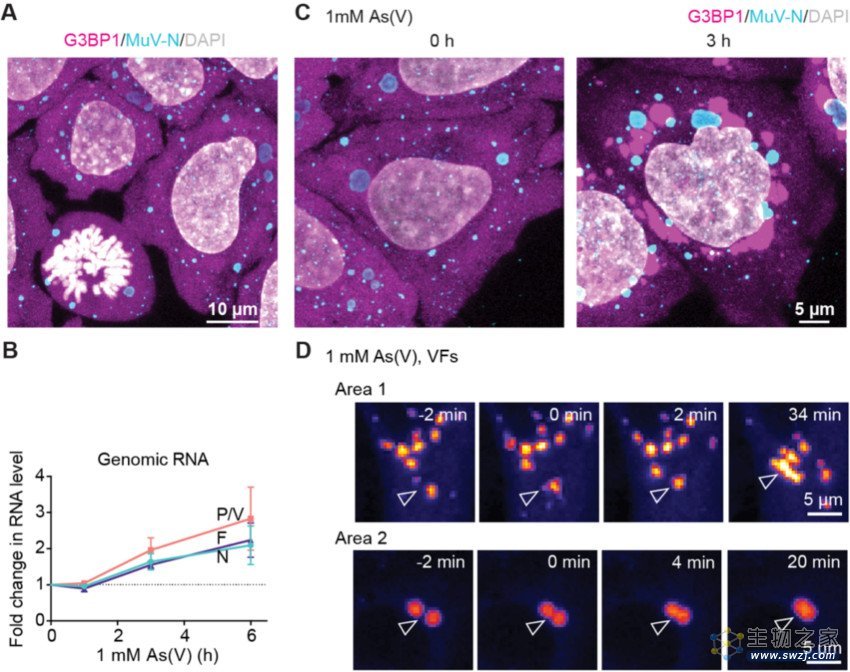
图1 | 细胞应激状态下持续性感染的腮腺炎病毒复制增强。(A)意外发现的持续性腮腺炎病毒(MuV)感染模型(G3BP1为应激标记蛋白)。(B)氧化应激条件下复制水平上升。(C)免疫荧光染色观察到病毒复制工厂在应激条件体积增大、数目减少。(D)将复制工厂(VF)凝聚相形成的主要组分即磷酸化蛋白的基因转染细胞后观察到的复制工厂的类似液态属性。
为了理解细胞应激导致腮腺炎病毒激活的机制,研究人员首先利用免疫染色及光学显微镜观察这些持续性感染的细胞在受到应激处理时会发生怎样的变化。结果显示随着细胞处理时间的延长,应激颗粒逐渐形成,而病毒复制工厂这一微米尺度的细胞内结构的体积也逐渐变大,同时数目减少。进一步研究发现病毒复制工厂类似应激颗粒,也是具有类似液态属性的凝聚相,由其主要组分高度无序的磷酸化蛋白(phosphoprotein)介导形成。这些复制工厂在细胞受到应激处理时呈现动态性,小的凝聚体可以融合形成更大的凝聚体。
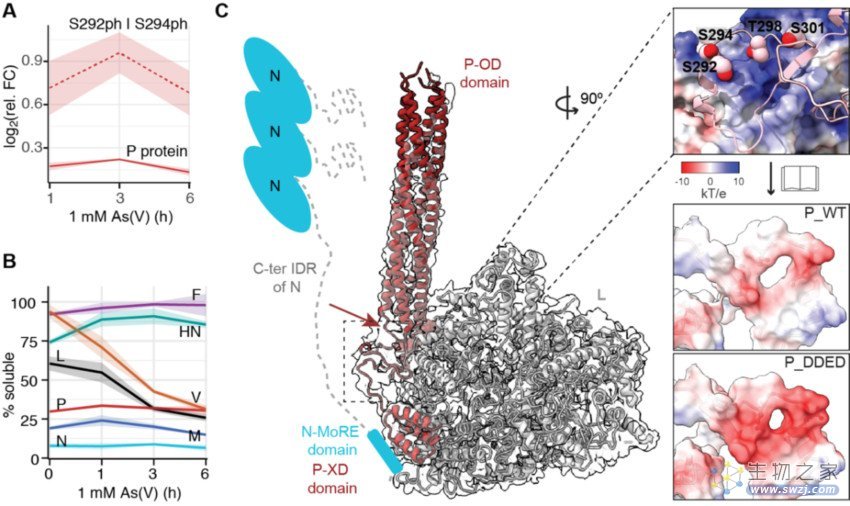
图2 | 细胞应激引发病毒复制工厂中蛋白作用网络的变化。(A)应激条件下病毒的磷酸化蛋白(标记为P)的磷酸化水平增高。(B)同时,病毒聚合酶蛋白(标记为L)的溶解度下降。(C)AlphaFold2建模及同源比对表明磷酸化位点可能影响病毒聚合酶复合体的稳定性。
随后,研究人员利用质谱定量系统分析了在细胞应激状态下,病毒及宿主细胞蛋白质组的变化,包括蛋白表达水平、磷酸化水平和溶解水平等。虽然病毒蛋白在细胞内水平未明显变化(胞外水平检测到上升),有趣的是在磷酸化蛋白的多个位点的磷酸化水平有明显的上调,同时与其相互作用的病毒RNA聚合酶的溶解水平明显降低(可能更多的进入其复制工厂凝聚相)。AlphaFold2建模及同源比对表明这些磷酸化位点刚好位于病毒磷酸化蛋白与其RNA聚合酶的结合位点处。后续的蛋白质密度梯度离心、免疫亲和纯化、突变体分析等实验表明,该磷酸化水平的升高的确与病毒聚合酶复合物在细胞应激状态下的稳定性升高相关。另外,与对应条件下病毒活性的上调相一致,宿主免疫响应水平明显下调。
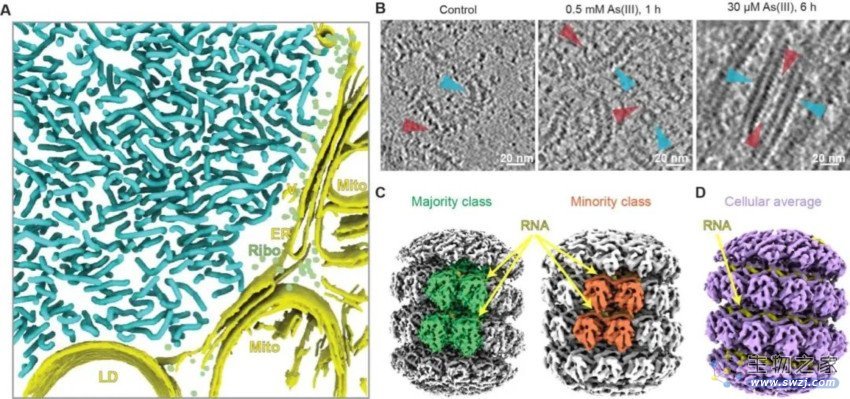
图3 | 腮腺炎病毒复制工厂及其核衣壳蛋白在应激条件下的形态及构象变化。(A)复制工厂在较短时间应激处理时的形态(cryo-ET图像分割;湛蓝色为核衣壳纤维)。(B)随应激时间延长,复制工厂和核衣壳纤维形态的变化,及相互作用蛋白富集。(C)对短时间应激时分离的核衣壳纤维进行亚断层平均(subtomogram averaging)产生的松散(绿色;分辨率4.5 Å)和紧凑(橙色;分辨率6.3 Å)两种构象。分离试验中对核衣壳纤维进行肝素处理使其伸直用于数据分析。(D)对较长应激时细胞原位的伸直的核衣壳纤维进行亚断层平均仅鉴定到松散的构象(分辨率6.5 Å)。
最后,研究人员利用cryo-ET对应激处理不同时间点的病毒复制工厂分别进行了细胞原位成像及结构解析(subtomogram averaging)。结果显示随着应激时间的延长,细胞内病毒复制工厂变的更加拥挤,与病毒核衣壳相互作用的分子更加富集,并有趣的伴随着核衣壳螺旋形纤维由弯曲到伸直的形态变化(伸直形态被报道与慢性肌炎相关)。较高分辨率的结构分析表明,其弯曲的形态对应着紧凑和松散两种组装构象,而伸直的形态则几乎都是松散的构象。后者使得核衣壳上缠绕的病毒基因组RNA及核衣壳蛋白的羧基端无序结构(IDR)更容易暴露出来,完成其与病毒复制相关的功能,从而进一步支持应激状态下病毒复制的上调。
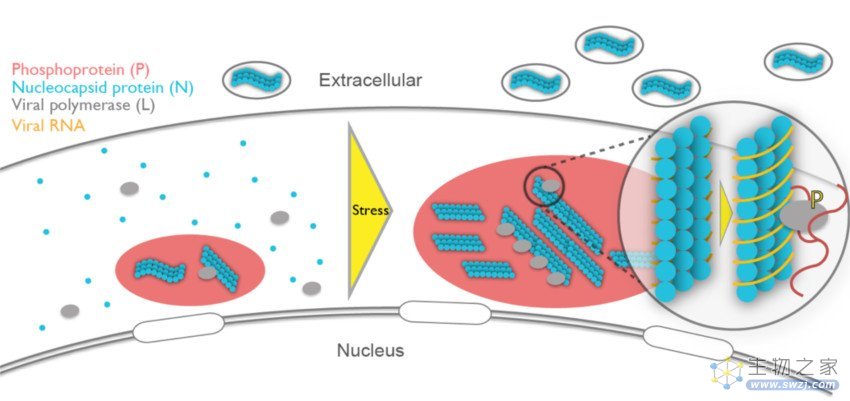
图4 | 该研究提出的相分离的腮腺炎病毒复制工厂在应激条件下激活的工作模型。
综上,该研究整合了前沿的细胞原位cryo-ET、cryo-CLEM、AlphaFold2建模、质谱定量、光学成像等,跨空间尺度地分析了持续性感染的腮腺炎病毒的复制工厂这一凝聚相的应激变化。这为未来进一步探索应激条件下引起这些分子事件的信号通路、以及腮腺炎病毒持续性感染与慢性疾病发生的关联等提供了基础。重要的是,该研究表明细胞原位cryo-ET与这些技术的整合,有望带来很多结构细胞生物学的新发现。
该研究由欧洲分子生物学实验室(EMBL)Julia Mahamid课题组和Mikhail M. Savitski课题组完成,Christoph W. Mueller课题组提供了帮助,德国马普所分子细胞生物学与遗传学分所 (MPI-CBG)Christina Eugster Oegema 提供了RNA定量数据,Anthony A. Hyman及实验室提供了重要建议和帮助。
张潇洁博士近期将加入上海科技大学生命科学与技术学院、iHuman研究所,将诚聘数名博士后、技术人员组建研究团队,从事免疫及代谢中相分离凝聚体的结构细胞生物学研究。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00276-3































