
要想最大程度地发挥治疗潜力,提高工程细胞的疗效和安全性,往往需要在细胞中表达大片段基因或复杂的基因回路。例如在构建CAR-T细胞时,通过在T细胞中导入嵌合抗原受体(CAR)基因,从而改善T细胞对癌细胞的杀伤能力。CRISPR激活(CRISPRa)、CRISPR干扰(CRISPRi),以及逻辑门,可以进一步增强CAR-T细胞治疗效果,但其在原代细胞中的长期表达仍然是一大挑战。
转基因沉默(Transgene silencing)是使用这些工具进行复杂细胞工程和治疗时面临的主要障碍。这一现象指的是,使用慢病毒或逆转录病毒载体整合在原代细胞中的基因会随着时间推移而表达减少,甚至完全丧失。而这种现象往往在工具开发时被忽视了。
2023年5月1日,斯坦福大学亓磊团队在 Nature Biomedical Engineering 期刊发表了题为:Stable expression of large transgenes via the knock-in of an integrase-deficient lentivirus 的研究论文。
该研究开发了一种敲入和稳定表达大片段DNA以及在两个内源位点同时敲入两个基因的方法——CLIP(CRISPR for Long-fragment Integration through Pseudovirus)。利用整合酶缺陷慢病毒和Cas9-RNP,能够以低细胞毒性在原代T细胞中高效插入和稳定表达大片段DNA(6kb)和两种难表达病毒抗原。CLIP为制造工程原代细胞提供了一种可扩展、有效的新方法。

要想在人类原代细胞中靶向插入和稳定表达大片段基因,需要稳健、高效和易于实现的方法。通过慢病毒或逆转录病毒载体递送DNA,通常会将DNA半随机插入宿主细胞基因组中,而这种方式还容易受到转基因沉默的影响。
利用同源定向修复(HDR)将有DNA片段置于细胞内源性必需基因(例如表达actin-β蛋白的ACTB基因,actin-β是重要的细胞骨架蛋白)的上游和框内,可以克服转基因沉默的问题,但这通常会导致敲入效率低下和细胞毒性。
为了克服这一障碍,亓磊团队开发了一种名为CLIP(CRISPR for Long-fragment Integration through Pseudovirus)的方法,实现了大片段DNA(可长可达6kb)的敲入和稳定表达,还能够在两个内源性位点同时敲入两个基因。
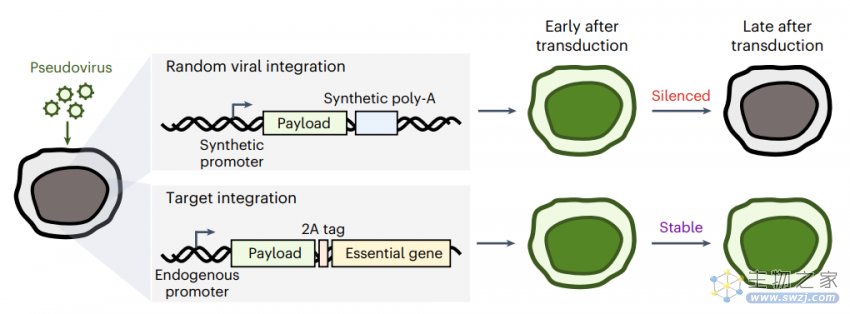
使用慢病毒载体会将携带的DNA片段半随机整合到基因组中,容易导致转基因沉默。而CLIP通过HDR介导的大片段DNA敲入必需基因位点,能够实现稳定表达
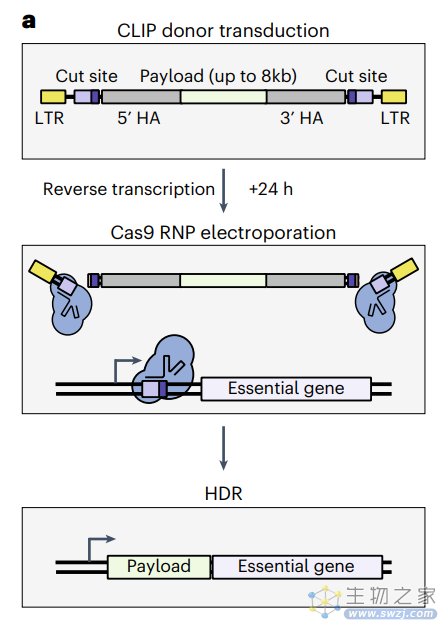
具体来说,该方法利用了整合酶缺陷的慢病毒(IDLV)来编码同源臂和“切割位点”两侧的有效载荷(大片段DNA),将有效载荷插入内源性必需基因的上游和框架内,然后通过电穿孔递送CRISPR-Cas9的核糖核蛋白复合物(Cas9-RNP)。
整合酶缺陷的慢病毒(IDLV)的整合酶发生了D64V突变,其维持了该酶包装和核定位病毒基因组的能力,但显著降低了其随机整合到基因组中的能力。而电穿孔导入的Cas9-RNP在宿主细胞中产生靶向DNA双链断裂,从而在该位点进行同源定向修复(HDR),实现有效载荷(大片段DNA)的定向敲入。
为了验证CLIP技术的效果,研究团队使用CLIP技术向原代T细胞中成功敲入了几个之前难以表达的蛋白,包括新冠病毒的S蛋白、Cas13、dCas12a等等,并能维持期长期表达。这有助于疫苗和抗体研究,还有助于开发更好的细胞疗法。
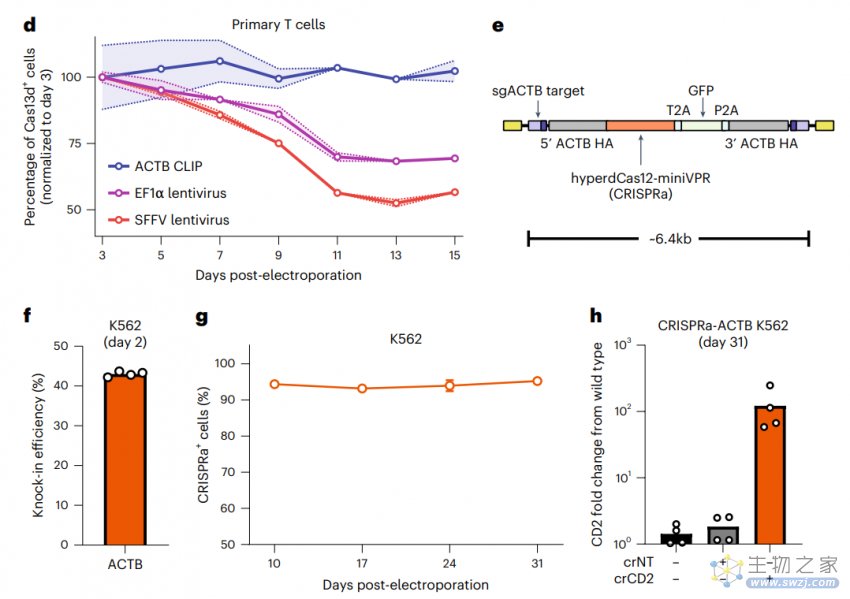
总的来说,开研究开发的CLIP技术能够以低细胞毒性在原代T细胞中高效插入和稳定表达大片段DNA(可长达6kb),这为易沉默转基因表达提供了一种新策略,为开发工程原代细胞疗法提供了一种可扩展和有效的新方法。
论文链接:
https://www.nature.com/articles/s41551-023-01037-x































