RNA疗法通过直接控制体内特定细胞内蛋白质的生成,在多种疾病的治疗方面具有巨大潜力。特别是使用脂质纳米颗粒(LNP)的非病毒载体递送mRNA,已成为一种有吸引力的治疗性蛋白质递送方法,因为mRNA的表达具有瞬时性,并且人工合成的纳米颗粒载体具有可重复给药的优势。目前,mRNA-LNP已在疫苗、基因编辑疗法、蛋白质替代疗法中展现了强大潜力。
尽管RNA疗法已取得了许多进展,但现在仍需开发安全、特异性和高效的递送载体。用于mRNA递送的纳米颗粒载体的开发中面临的一大挑战是体外研究难以预测其在体内的分布和效果,而传统的体内研究的通量又不足。虽然这些问题可以通过批量分析、DNA条形码、RNA条形码等方法得到部分解决,但这些方法都有着各自的缺点,限制了它们在临床前研究中作为筛选方法的应用,从而导致了开发新的安全有效的纳米颗粒递送载体缓慢而昂贵。
2023年5月1日,麻省理工学院(MIT)的 Daniel Anderson 教授团队在 Nature Biomedical Engineering 期刊发表了题为:Peptide-encoding mRNA barcodes for the high-throughput in vivo screening of libraries of lipid nanoparticles for mRNA delivery 的研究论文。
该研究开发了一种多肽编码的mRNA条形码,能够在体内实现高通量和准确的用于mRNA递送的脂质纳米颗粒(LNP)文库的筛选。

2018年10月,James Dahlman团队开发了一种体内筛选纳米颗粒载体的方法——FIND(Fast Identification of Nanoparticle Delivery),该方法使用与Cre mRNA和DNA条形码共配制的LNP与转基因Ai14小鼠结合,称为“FIND”。该方法使用LNP与Cre mRNA和DNA条形码共同配制的纳米颗粒进行功能性mRNA递送,在转基因的Ai14小鼠模型体内进行筛选。简而言之,在该系统中,成功转染的细胞将持续表达红色荧光蛋白(tdTomato),与tdTomato荧光信号共定位的DNA条形码可以作为递送效率的间接量化。
这种方法虽然比之前的DNA条形码分析技术有了显著进步,但仍有着几个重要的局限性。例如,被内化或保留在目的细胞表面的纳米颗粒也会显示荧光;目的细胞只要被单一个纳米颗粒成功转染就会显示荧光,这些都会导筛选的假阳性,从而导致错误的筛选结果。此外,该方法依赖于转基因Ai14小鼠模型,因此无法将其用于其他大型动物模型以及Cre-Lox报告系统不可用的特定疾病模型的筛选。
在这项最新研究中,Daniel Anderson 教授团队开发了一种基于多肽条形码的筛选系统,通过将不同多肽条形码的编码mRNA包装到不同类型的脂质纳米颗粒(LNP)中,从而实现同时评估同一动物体内的多个LNP。
将被不同多肽条形码编码的不同LNP合并到一起,单剂量给药于同一只动物,一旦其成功递送mRNA到目标组织或细胞中,并完成了多肽的翻译,每个多肽条形码序列的表达可以使用液相色谱串联质谱(LC-MS/MS)进行定量分析。
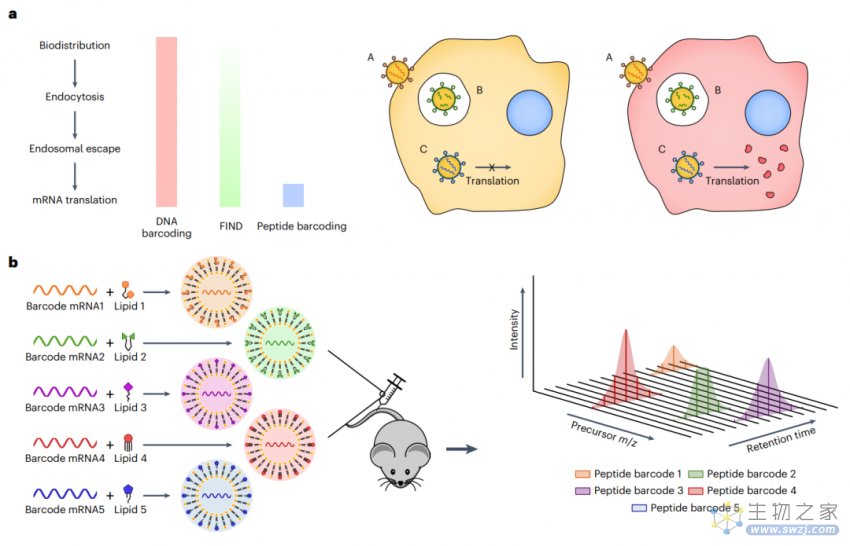
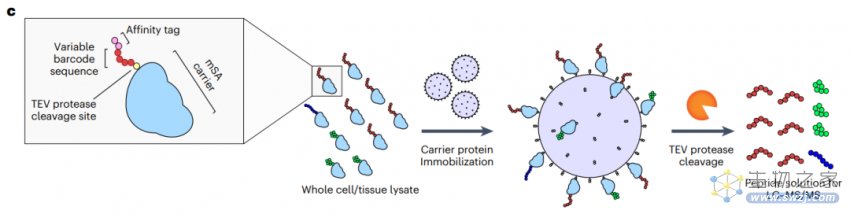
每个独特的LNP配方会产生自己独特的测量结果,从而可以直接在目标组织或细胞类型中量化分析受其影响的蛋白质产量。由于该方法不依赖于任何报告基因的存在,因此它本身与动物模型无关,理论上可以在任何临床前模型中进行筛选。
在这项研究中,通过应用液相色谱串联质谱,能够在体外和体内模型中准确地检测和量化多达65种不同mRNA LNP的多肽条形码的表达,并且在很宽的动态范围内。
然后,研究团队应用该系统筛选了384种可电离脂质文库,超过400种不同的LNP,以了解它们影响肝脏蛋白质生产的能力,整个实验只用了9只小鼠就得以完成,并基于此开发了一种新的可生物降解的LNP——RM133-3-21,它能够用于体内有效的功能性mRNA递送。
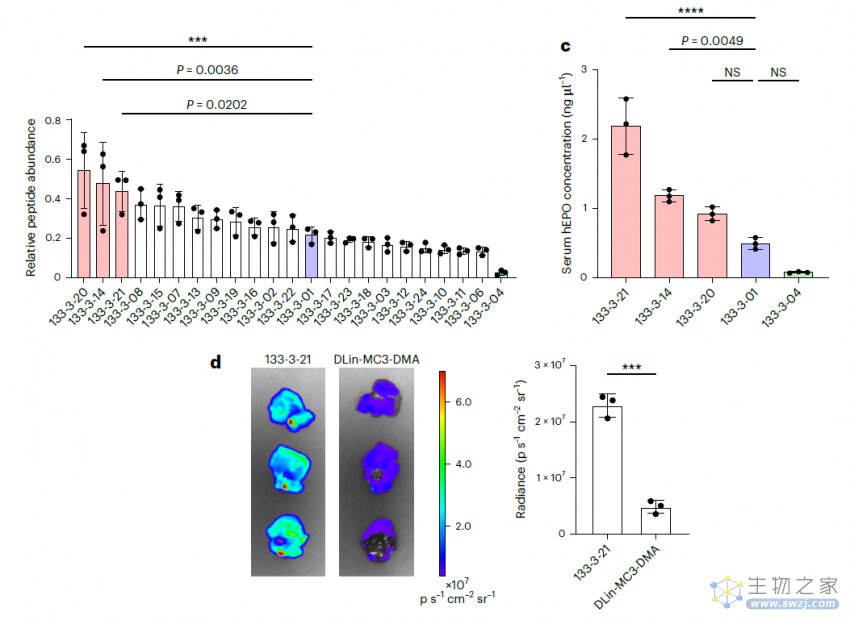
总的来说,该研究证明了多肽条形码技术可用来快速、高效筛选大量纳米颗粒载体库,在这项研究中,仅使用了9只小鼠就从包含384种新的可电离脂质的400多种LNP配方中筛选到了新的可生物降解的LNP。此外,该方法还可以用于在肝外组织中筛选可用靶向递送载体。
论文链接:https://www.nature.com/articles/s41551-023-01030-4































