细胞代谢重编程是恶性肿瘤的重要标志之一,识别和阻断肿瘤代谢进程重要调控途径业已成为肿瘤靶向治疗关注热点。目前研究表明,微量元素代谢异常在肿瘤发生发展中扮演重要角色,其中铁离子作为人体重要微量元素,参与包括DNA合成、氧运输和细胞呼吸链合成在内诸多生理活动,铁代谢失调与肿瘤发生发展密切相关。深入探究肿瘤细胞铁代谢节点分子调控事件,或将为恶性肿瘤临床干预提供新思路和新策略。
长链非编码RNA(lncRNAs)作为一类长度大于200nt的转录本,业已证明其参与诸多重要细胞生命活动进程,包括细胞周期、代谢增值等,并在肿瘤发生发展中发挥重要调控功能。研究表明,lncRNAs功能发挥与细胞定位密切相关,浙江大学林爱福课题组在内前期研究发现,细胞膜脂结合LINK-A促进了细胞质膜PIP3-AKT信号转导,细胞质CamK-A介导了Ca2+信号与NF-κB信号交互调控Ca2+依赖性激酶活性重塑肿瘤微环境,磷脂结合SNHG9介导LATS1液-液相分离调控YAP肿瘤信号活化和肿瘤发生发展,细胞质MAYA形成MAYA-ROR1-HER3信号轴通过Hippo信号通路调控乳腺癌骨转移,细胞器-线粒体GAS5和溶酶体-SNHG6动态区室化分布调控细胞代谢,上述发现,丰富和扩展了lncRNAs在细胞信号转导和细胞代谢相关研究领域,并为肿瘤等重大恶性疾病临床干预提供了理论指导和临床借鉴。
近日,浙江大学生命科学学院林爱福课题组在Nature Communications杂志在线发表为LncRNA Modulates Hippo-YAP Signaling to Reprogram Iron Metabolism 的研究论文。该研究发现铁动态响应的 lncRNA LncRIM通过与Hippo通路上游节点分子NF2互作,抑制LATS1激酶活性,继而促进YAP下游铁代谢调控重要靶基因DMT1和TFR1表达,并通过放大LncRIM-NF2-DMT1/TFR1反馈调控信号,持续推动细胞铁代谢重编程系列分子调控事件发生,最终导致铁依赖的细胞增值和乳腺癌发生发展。该研究首次阐明细胞膜定位lncRNA通过介导Hippo信号通路调控细胞铁代谢调控的新机制,提示靶向LncRIM-NF2-YAP铁代谢信号轴或可成为潜在临床干预新策略。

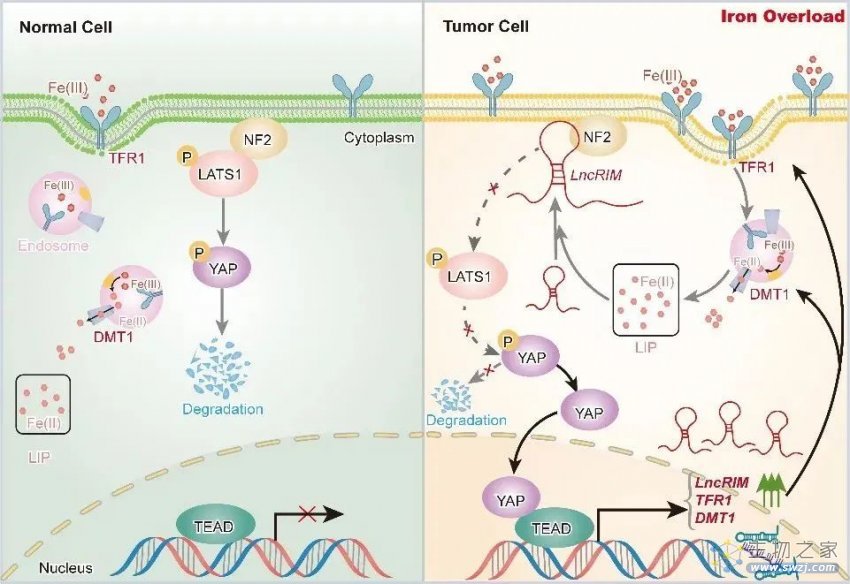
研究人员首先利用生物信息学分析和乳腺癌临床样本芯片组学分析,发现Hippo信号通路与细胞铁代谢存在潜在联系,进一步提供筛选鉴定得到具有铁动态响应、铁代谢调控功能并与YAP信号关联的节点lncRNA LncRIM,并发现其与乳腺癌患者不良预后显著相关。
进一步通过深入机制解析,发现细胞质膜定位LncRIM直接作用于Hippo信号通路上游节点分子NF2的FERM结构域。LncRIM-NF2互作和膜定位继而抑制下游节点激酶LATS1细胞膜定位和后续激酶活化,从而导致YAP入核并促使下游靶基因DMT1和TFR1上调表达,驱动细胞铁代谢重编程事件发生。此外,研究发现Hippo信号能够通过响应细胞铁离子浓度变化,形成LncRIM-NF2-YAP反馈信号调控轴,最终导致铁离子触发的铁代谢信号异常调控与肿瘤恶性进展。
此外,通过构建裸鼠皮下和原位荷瘤模型研究LncRIM介导的细胞铁代谢重塑在体内肿瘤生长的调控作用,发现过表达LncRIM通过抑制Hippo信号通路和上调细胞内铁离子水平促进小鼠乳腺癌的发生发展,而敲除下游效应因子DMT1和TFR1则显著的抑制LncRIM介导的铁代谢激活和肿瘤生长。在此基础上,研究人员使用临床用铁离子螯合剂DFO对小鼠进行腹腔注射,发现降低铁离子浓度能够显著抑制LncRIM-NF2信号轴驱动的YAP分子激活和肿瘤生长,上述发现也为临床药物开发提供了潜在靶点。
本研究解析了lncRNA节点分子、Hippo信号通路与微量元素铁代谢之间的精确作用机制,深入揭示了微量元素代谢异常在肿瘤等重大疾病发生发展进程中的重要生理病理意义。此外,该研究揭示了LncRIM-NF2-DMT1/TFR1铁代谢信号轴的调控功能和作用机理,为肿瘤临床干预提供新的理论参考和临床借鉴。
浙江大学生科院博士生何欣豫和樊晓为论文的共同第一作者,通讯作者为林爱福教授和美国加州大学王闻起教授。研究工作也得到了王福俤教授、邵建忠教授、严庆丰教授等合作者的大力支持。
原文链接:https://www.nature.com/articles/s41467-023-37871-5
转载自:https://mp.weixin.qq.com/s/ghNJ_YUKuFi-7oCu45wkDw































