2023年转瞬过半,国内外新药“百花齐放”。肿瘤领域一直是新药研发的重点,仅上半年,就有16款抗癌新疗法获得了美国食品药品监督管理局(FDA)的重磅批准,一些癌症类型甚至打破了治疗僵局,迎来了首款靶向药物,为万千患者带来了生命的希望。

那么上半年获批的抗癌新药都有哪些呢?小编汇总后盘点如下:
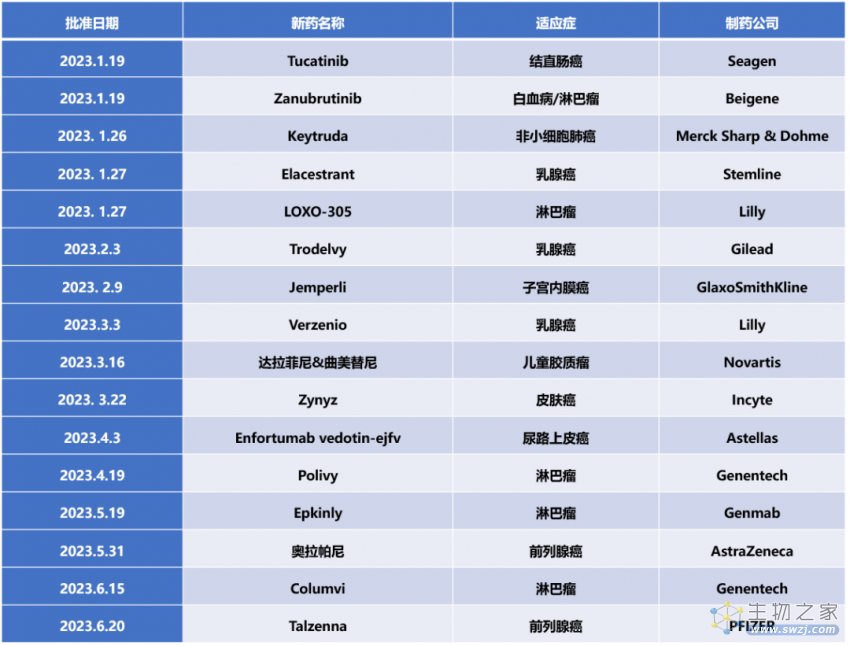
可以看出,上半年FDA批准的新药覆盖了多种实体瘤和血液肿瘤类型。其中有几种代表性的药物,小编汇集了它们的临床效果以供大家参考~
1. 药物名称:Tucatinib
公司名称:Seagen
适应症:结直肠癌

2023年1月19日,FDA批准图卡替尼(TUKYSA)与曲妥珠单抗联合用于既往治疗过的RAS野生型HER2阳性转移性结直肠癌。这是FDA批准的首款HER2阳性转移性结直肠癌的疗法。
HER2是移性结直肠癌重要的治疗靶点,据统计,在3%~5%的晚期或转移性结直肠癌患者中发现HER2扩增或过表达,更容易出现在左侧或者右侧的肿瘤中。在代号为MOUNTAINEER的II期试验 (NCT03043313)中,84名接受Tucatinib联合曲妥珠单抗治疗组,确认的客观缓解率(ORR)为38.1%,这意味着在接受了全新的组合方案治疗后,竟然有近40%的患者肿瘤显著缩小30%以上甚至消失。此外,患者的中位总生存期 (OS) 为24.1个月,超过了2年。
2.药物名称:Zanubrutinib
公司名称:Beigene
适应症:慢性淋巴细胞白血病和小淋巴细胞淋巴瘤

作为第一个走出国门的中国本土抗癌新药,Zanubrutinib是一种小分子BTK抑制剂,特点在于最大化对BTK靶点的特异性结合,从而最大程度减小脱靶效应而带来的毒副作用。
II期中国临床试验BGB-3111-206(NCT03206970)中,86例成年复发/难治性(R/R)MCL患者接受了160mgZanubrutinib治疗,每日两次,直至疾病进展或毒性不可耐受。结果显示,客观缓解率(ORR)为84%(95%CI,74%-91%),其中完全缓解(CR)率为59%,部分缓解(PR)率为24%。中位随访18.8个月,中位持续缓解时间(DOR)为19.5个月(95%CI,16.6-NE)。
在国际I/II期BGB-3111-AU-003(NCT02343120)试验中,32例既往接受过治疗的MCL患者接受泽布替尼治疗,每日总剂量320mg。结果显示,ORR为84%(95%CI,67%-95%),其中CR率为22%,PR率为62%。在中位随访18.8个月时,中位DOR为18.5个月(95%CI,12.6–NE)。
3.药物名称:Elacestrant
公司名称:Stemline
适应症:乳腺癌

FDA批准Elacestrant用于既往接受过至少一线内分泌治疗后疾病进展的ER+、HER2-、ESR1突变的绝经后女性或成年男性晚期或转移性乳腺癌患者。这也是FDA批准的首个口服雌激素受体降解剂(SERD),在此之前,阿斯利康的Fulvestrant是唯一获批上市的SERD 靶向药,但只能肌肉注射。
Elacestrant可剂量依赖性地降解雌激素受体α,抑制雌二醇依赖的ER导向基因转录和肿瘤生长。Ⅲ期临床试验EMERALD招募了478例ER阳性、HER2阴性晚期或转移性绝经后女性和男性患者,其中228例患者有ESR1突变。该试验要求患者在既往接受过一线或二线内分泌治疗(包括含CDK4/6抑制剂的一线治疗)后出现疾病进展。在228例有ESR1突变的患者中,Elacestrant组和Fulvestrant/芳香化酶抑制剂组的中位无进展生存期(PFS)分别为3.8个月和1.9个月;此外,Elacestrant将进展风险降低了45%。
4.药物名称:LOXO-305
公司名称:Lilly
适应症:淋巴瘤

该药物是FDA批准的首款也是唯一一款非公价(可逆)BTK抑制剂。BTK在B细胞抗原受体信号传导途径中起着关键作用,是正常白细胞(B细胞)和恶性B细胞发育、活化和生存所必需的,因此可作为疾病控制的一个有效分子靶点,包括慢性淋巴细胞白血病(CLL)、Waldenstrom巨球蛋白血症、套细胞淋巴瘤(MCL)和边缘区淋巴瘤(MZL)。
LOXO-305全球多中心I/II期临床数据显示,在可进行疗效评估的139例 CLL/SLL患者中,总体有效率(ORR)为 63%(95%CI:55-71)。其中121例可评估疗效的既往BTK抑制剂治疗失败的患者ORR为62%(95%CI: 53-71),随访10个月或更长时间的ORR上升到84%。随着时间的推移,缓解的程度增加。
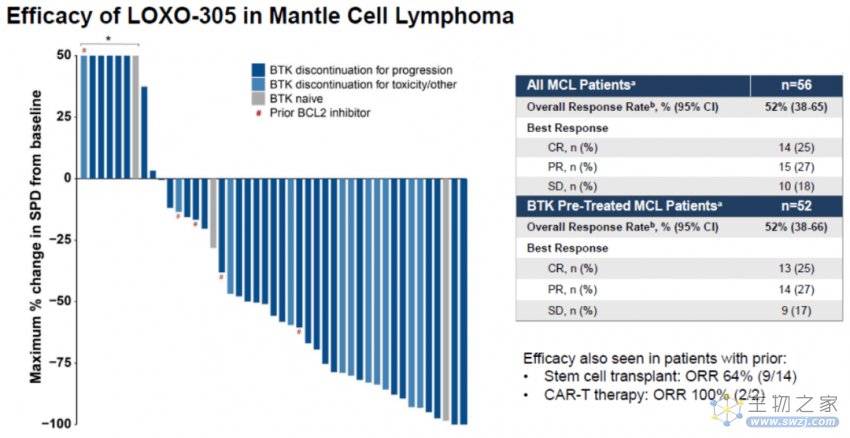
LOXO-305治疗套细胞淋巴瘤(MCL)的疗效观察。(图片来源:2020 ASH)
5.药物名称:Trodelvy
公司名称:Gilead
适应症:乳腺癌

三阴乳腺癌(TNBC)约占所有乳腺癌比例的15%,与其他类型乳腺癌相比,TNBC在50岁以下女性中更为常见。Trop-2是一种在许多上皮性肿瘤(包括TNBC)中频繁表达的细胞表面蛋白,在90%以上的TNBC中表达。Trodelvy是一款靶向Trop-2的新型、首创的抗体偶联药物。
在III期ASCENT研究(NCT02574455)中,与化疗相比,Trodelvy将无进展生存期(PFS)显著延长(中位PFS:4.8个月vs1.7个月)、将患者疾病进展或死亡风险显著降低57%(HR=0.43,p<0.0001)、将总生存期(OS)显著延长(中位OS:11.8个月vs 6.9个月)、将患者死亡风险显著降低49%(HR=0.51,p<0.0001)。
6.药物名称:Jemperli
公司名称:GlaxoSmithKline
适应症:子宫内膜癌

Jemperli是欧美市场第一个用于治疗子宫内膜癌的抗PD-1疗法。
GARNET是一项多中心、非随机、多平行队列、开放标签研究。大多数患者(n=81)曾接受过2种或更多种的系统治疗。研究中,患者接受每3周一次500mg剂量Jemperli治疗4次,此后每6周一次1000mg剂量Jemperli直至2年或直至疾病进展或停药。研究的主要目标是通过盲法独立中心审查,根据RECIST V1.1评估客观缓解率(ORR)和缓解持续时间(DOR)。
结果显示,在所有错配修复缺陷(dMMR)实体瘤(n=209)中,ORR为41.6%(95%CI:34.9-48.6)、完全缓解率(CR)为9.1%、部分缓解率(PR)为32.5%。中位DOR为34.7个月(范围2.6-35.8+),95.4%的患者DOR在6个月或更长时间。
7.药物名称:Padcev
公司名称:Astellas
适应症:尿路上皮癌

Padcev是一种首创的抗体药物偶联物(ADC),靶向在膀胱癌中高度表达的一种细胞表面蛋白(Nectin-4)。
Padcev单药疗法(EV-201研究[NCT03219333]队列2)实验,是第一个报告抗PD-L1免疫治疗后病情进展的晚期尿路上皮癌(UC)患者的客观缓解数据研究。患者因身体状况无法接受顺铂化疗,中位随访16个月后,接受Padcev治疗的患者中,确认的客观缓解(ORR)为51%(95%CI:39.8-61.3),完全缓解率(CR)为22%。中位缓解时间(DOR)为13.8个月(95%CI:6.4-未达到)。中位无进展生存期(PFS)为6.7个月(95%CI:5.0-8.3),中位总生存期(OS)为16.1个月(95%CI:11.3-24.1)。
现如今肿瘤新药年年勇攀高峰,相信随着医学研究的不断深入,未来将有更多的肿瘤患者得以迎接新生,让我们拭目以待!
参考文献:
[1] FDA approves pembrolizumab as adjuvant treatment for non-small cell lung cancer. News release. FDA. January 26, 2023. Accessed January 26, 2023. https://www.fda.gov/drugs
[2] Keytruda. Prescribing information. Merck; 2023. Accessed January 26, 2023.































