2023 年即将过去,在这一年里,我们见证了科研界许多重大的变革与突破。在这一年里,生物领域和跨领域的研究突飞猛进,在 2023 年的最后一天来盘点一下这一年都发生了什么大事吧!

人体免疫系统发育图谱绘制
今年 9 月,中国科学家成功绘制了人体免疫系统发育图谱。
人体像是一台「不停运转」的机器,在机器运行之初,免疫细胞就开始快速地增殖、分化和迁移,这为研究组织器官区域免疫特性的形成与发展提供了独特的时间窗口。
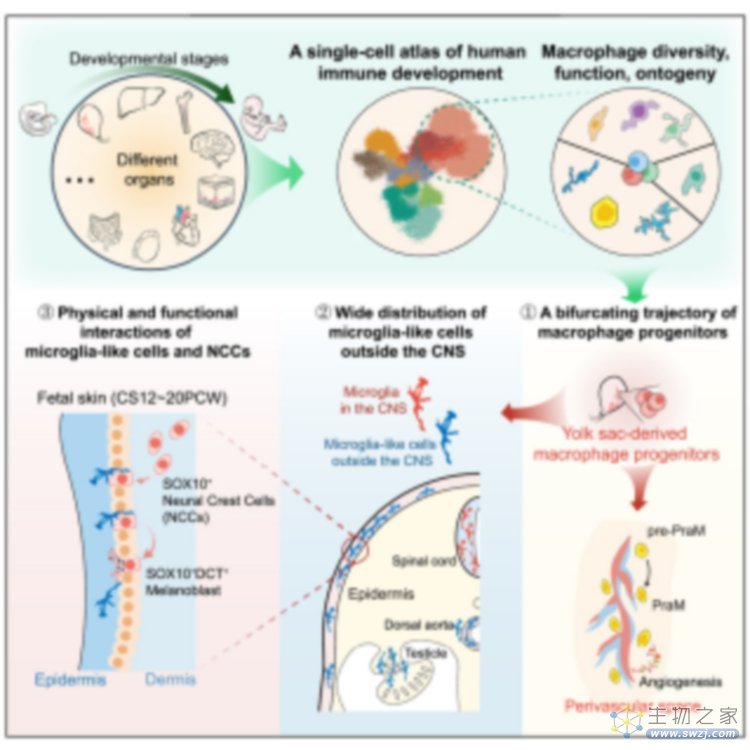
研发团队通过自主搭建的单细胞转录组测序平台对发育中的 30 万个免疫细胞进行「解码」,成功构建了研究领域内组织范围最广、时间跨度最大、采样密度最高的高分辨率人类免疫系统发育图谱。
图片来源:文献截图
通过鉴定 11 种主要的免疫细胞类型,并对每一种主要的免疫细胞类型进行了更细致的分类,最终注释得到包括 15 种巨噬细胞在内的 56 种免疫细胞亚型,并将它们的时空动态变化轨迹精准的描绘在图谱中。
明确免疫细胞类型、分化及功能状态,对理解免疫力和揭示免疫相关疾病的发生发展机制具有重大的科学意义,也有助于深入理 解免疫系统的功能和调控机制,为疾病诊断、免疫治疗和新疗法开发奠定了重要基础。
该研究成果已发表于 Cell,有望推动全球免疫学和发育生物学领域的发展。
图片来源:Cell 官网截图
人类首次重新设计并合成了真核细胞的全基因组
人工合成酵母基因组计划(Sc2.0 Project),开始于 2011 年,由中国、美国、英国、新加坡、澳大利亚等国参与,旨在重新设计并合成酿酒酵母的全部 16 条染色体。这是人类第一次尝试对真核生物的基因组进行从头设计合成。
以酵母为切入点,主要因为它是科学家们公认的,研究真核生物生命活动的经典模式生物,其细胞结构和生理过程相对简单且具有代表性,在人类社会中被广泛应用于生物降解、食品加工、医药等领域。
2017 年,Sc2.0 项目已完成酵母 5 条染色体的从头设计与全合成。今年 11 月 8 日,Sc2.0 项目再次发布最新研究成果,完成了酵母剩余 10 多条染色体的从头设计与全合成。
研究成果通过 Cell 及其子刊上多篇研究论文向全世界呈现。该研究标志着世界首个真核生物全部染色体的从头设计与合成正式完成,是生物学领域的一座里程碑,为未来合成基因组学的研究奠定了重要参考。

当期期刊封面 图片来源:期刊官网
该项目的完结,能够帮助人们更好地理解人类等高等真核生物的基因功能和调控机制,加速合成生物学的产业应用。比如,对酵母 7 号染色体的从头设计与全合成,能够构建合成型酵母的非整倍体疾病模型,为染色体异常疾病的研究提供了新策略。
首个基因编辑疗法获批
2023 年 12 月 8 日,美国 FDA 批准两种治疗镰状细胞病(SCD)的基因疗法 Casgevy 和 Lyfgenia 上市。Casgevy 成为首个获 FDA 批准的基于 CRIPSR/Cas9 基因编辑技术的基因疗法,也是最早被 FDA 批准的 SCD 基因疗法之一。

图片来源:Yale Medicine
镰状细胞病被 WHO 和联合国定义为全球性公共卫生问题。目前该病在非洲、中东、印度等地肆虐,每年造成 11 万余人死亡。而随着全球各地移民潮,SCD 也开始在欧美流行。
传统上,治疗 SCD 的方法很有限,除了输血、止痛等对症治疗外,FDA 此前批准的四种疾病修饰疗法治疗方法均存在一定缺陷。
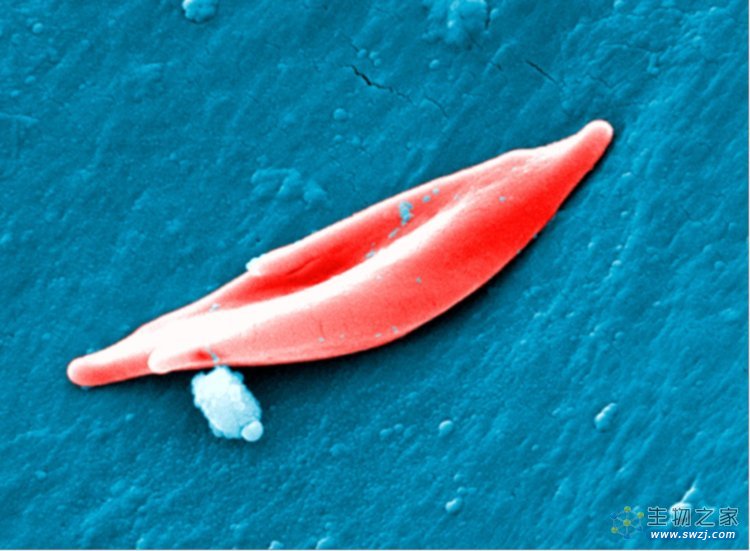
病患的镰状红细胞 图片来源:Nature 官网
而 Casgevy 则不同,它是基于 CRISPR/Cas9 基因编辑技术的基因疗法,通过在体外对患者造血干细胞进行编辑,重启胎儿血红蛋白(HbF)基因的表达。
HbF 是人类胎儿期赖以存活的血红蛋白形式,但在出生后其基因便会迅速被沉默,不过,对于 SCD 患者而言,HbF 的存在会抑制异常镰状红细胞的产生,提升携氧能力,大幅改善患者的溶血性贫血和血管阻塞现象。
通过临床研究,Casgevy 基因疗法在 SCD 人群中展现出了良好的疗效。31 名接受了 Casgevy 疗法并且完成随访的患者中,有 29 名在 24 个月的随访期内至少连续 12 个月未出现血管阻塞危象。
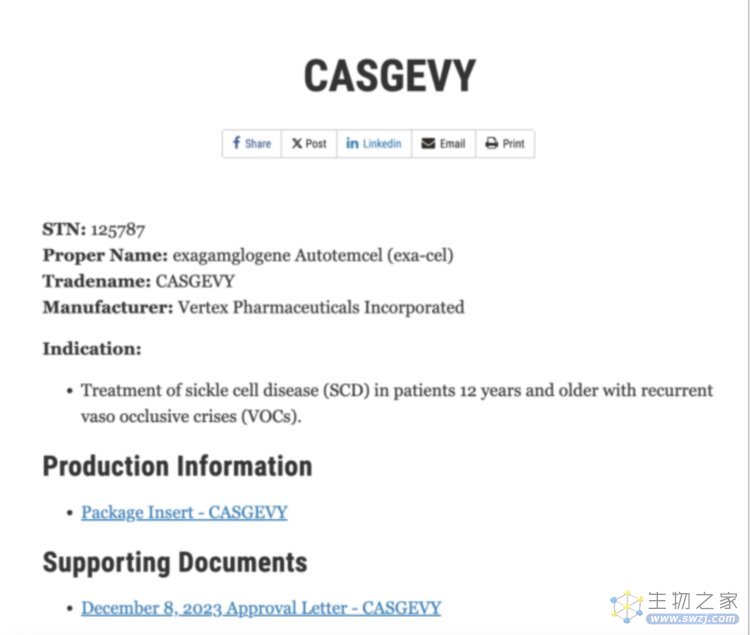
Casgevy 在 FDA 的备案信息 图片来源:FDA 官网
但 Casgevy 也有副作用,主要集中在为自体造血时,干细胞移植相关的血细胞减少和感染。另外,Casgevy 目前的定价 220 万美元(约合人民币 1570 万元)。过高的价格可能算是另一种「副作用」吧。
人工智能进入科研领域
在人工智能进入科研领域后,正不断颠覆着科研的玩法。
早在 2021 年,AlphaFold 已经在精准解析蛋白质三维结构方面取得突破。

图片来源:Nature 官网
之后两年,使用人工智能和机器学习不断设计和创造出全新分子。
图片来源:AlphaFold 官网
今年年初,在 Nature Biotechnology 上发表的一项研究利用 ChatGPT 背后的大型语言模型来学习蛋白结构和生物学的「语言」,研究团队开发出的 ProGen 模型能够生成与大自然中的溶菌酶活性相似但氨基酸序列迥异的全新蛋白。

图片来源:Nature 官网
华盛顿大学 David Baker 教授团队,在多家顶尖学术期刊上连续发表论文,揭示了利用人工智能设计蛋白复合体,靶向不可成药靶点的全新策略。
另外,华盛顿大学蛋白设计研究所首席战略及运营官 Lance Stewart 博士也表示,人工智能在预测蛋白结构、设计蛋白药物等方面取得了很大进步。
在人工智能的协助下,未来谈及不可成药性,不仅是指开发针对不可成药的药物,还包括开发筛选这些药物所用的工具。
同时,人工智能不仅可以加速临床试验,改善患者选择,还能通过数据分析找出最适合的治疗方案,使药物更加安全和有效。
mRNA 疫苗技术获诺贝尔奖
2023 年的诺贝尔生理学或医学奖,授予德国生物技术公司 BioNTech 的卡塔琳 · 卡里科(Katalin Karikó)和美国宾夕法尼亚大学教授德鲁 · 魏斯曼(Drew Weissman),以表彰他们在核苷碱基修饰方面的发现,这些发现使得针对 COVID-19 的有效 mRNA 疫苗得以开发。

图片来源:诺奖官网
mRNA 疫苗技术的落地,是人类文明史上的又一次「盗火」,可能会带来生物医药领域的巨变。
与历史上的减毒活疫苗、灭活疫苗,以及重组蛋白疫苗不同,mRNA 疫苗是核酸疫苗,在新冠疫情中首次用于对抗疾病,通过直接注射 mRNA 片段到体内表达特异性蛋白来保持持续的免疫应答,完善人体免疫系统。

图片来源:Nature 官网
从工程角度讲,mRNA 疫苗的临床应用也打开一片新天地。在疫苗的制造工艺上不再需要进行蛋白的表达和纯化,只合成基因即可。相关的工艺应用是极大的技术突破,特别对于突发传染病,应对优势非常明显。
用干细胞人工合成人类胚胎
2023 年中,预印本网站上线两篇「背靠背」论文,来自英国剑桥大学和美国耶鲁大学的两支研究团队分别报告了他们在「人工创造人类胚胎模型」上取得的突破性进展。随后,两份论文先后在 Nature 刊发。

图片来源:Nature 官网
图片来源:Nature 官网
在这项科研成果发布之前,人体内的人类胚胎最初两三周的发育过程,就如同一个黑匣子,是人类发育中最难研究的时期之一。如今,利用人类干细胞技术可以人工制造出一枚胚胎,以模拟人类胚胎的早期发育。
不同于卵子和精子结合形成的胚胎,全新的两种人类胚胎模型都是完全由生长于培养皿中的干细胞生成。
先前此类体外培养的胚胎发育模型仅包含胚胎成分,而新模型均有两个组成部分:除了胚胎外,还有支持胚胎生长的胚胎外组织(如胎盘和卵黄囊)。因此,它们可以用于模拟胚胎在植入后阶段的细胞变化,让研究人员突破无法在体内观察植入后胚胎的限制。
这些突破性的进展将会为阐明早期人类发育带来前所未有的机会,例如探索不同基因在发育过程中的作用。除此之外,从干细胞衍生而来的模拟人类胚胎,还可以帮助研究人员更好地了解出生缺陷并探测怀孕期间使用的药物的安全性。
2023 年马上就要结束,科研的步伐不会停止。跨过零点的钟声,在新的一年里,一定有更多技术的惊喜正在等着人类去探究和发现。































