当你下次想到基因编辑时,你应该想到维多利亚·格雷(Victoria Gray)——一位非洲裔美国女性,她的镰状细胞病已经被治愈了,至少目前是这样。
最近在伦敦,一些科学家参加了第三届人类基因组编辑国际峰会。这是基因编辑领域的重大会议,研究人员用他们研发的修改 DNA 的新能力来“震惊”观众,而伦理学家们则开始担心这一切意味着什么。
不过人们更应该关注的是,基因编辑如何通过治疗严重的、现有方法无法治愈的疾病来改变人们的生活。
(来源:STEPHANIE ARNETT/MITTR | ENVATO)
事实上,根据哈佛大学基因编辑专家大卫·刘(David Liu)与《麻省理工科技评论》分享的统计数据,目前有 50 多项实验研究正在进行中,他们在人类志愿者身上应用基因编辑技术,尝试治疗癌症、艾滋病和多种血液疾病。
这些研究中的大多数——大约 40 项都涉及到 CRISPR,这是最通用的基因编辑方法,大约在 10 年前才发展起来。
这就是格雷接受的疗法。2019 年,她是第一批接受 CRISPR 手术治疗的患者之一,当她在伦敦讲述自己的故事时,在场观众纷纷落泪。
“我今天站在你面前,就是奇迹出现的证据,”格雷谈到她与疾病的斗争。罹患这种疾病的人,其体内畸形的血细胞不能携带足够的氧气,所以会导致严重的疼痛和贫血。
但格雷的案例也显示了第一代 CRISPR——有时也被称为“CRISPR 1.0”所面临的障碍。它们又昂贵又难以实施,而且可能很快就会被下一代经过改进的药物所取代。
为格雷开发了治疗药物的Vertex 制药公司表示,该公司在镰状细胞和地中海贫血(一种相关的疾病)的研究中治疗了超过 75 人,这种疗法可能在一年内获得美国的批准。人们普遍认为,这将是市场上首个使用 CRISPR 的治疗药物。
Vertex 还没有透露它的价格,但大概会在数百万美元左右。
01
一个启示
研究人员表示,这项技术在医学领域的应用进展非常快。加州大学伯克利分校的研究人员费奥多尔·乌尔诺夫(Fyodor Urnov)说:“我认为 CRISPR 已经超过了之前所有的基因治疗技术。”
对科学家来说 CRISPR 是一个启示,因为它具备在特定位置剪切基因组的能力。它是由一个切割蛋白质和一个像 GPS 一样的短基因序列组成的,后者可以定位到染色体上特定的位置。
更重要的是,改变那个像 GPS 一样的序列很容易,加州大学伯克利分校的生物化学家詹妮弗·杜德纳(Jennifer Doudna)表示,“CRISPR 是一种能够改变可以被编程的 DNA 的技术。”她也曾因发明 CRISPR 而获得诺贝尔奖。
除了 Vertex,还有许多其他生物技术公司,比如Intellia、Beam Therapeutics 和 Editas Medicine,它们都希望利用这项技术来开发成功的治疗方法,它们中的许多家也都在刘的统计名单上,或多或少地在推进实验,但并非所有这些努力都能成功。
例如,2023 年 1 月,美国旧金山生物技术公司 Graphite Bio 不得不停止对镰状细胞基因编辑治疗的测试,因为其第一个受试患者的血细胞数量下降到了一个危险的水平。这个问题是由治疗本身造成的。当时,该公司的股价暴跌超过 90%,前景堪忧。
所有这些努力,最难的地方仍然是让 CRISPR 去到它该去的地方。这听起来容易做起来难。在格雷的案例中,医生摘除了骨髓细胞,并在实验室中进行了编辑。但在它们被放回她的体内之前,她接受了化疗以便杀死剩余的骨髓,从而为新细胞腾出空间。

▲图 | 维多利亚·格雷(Victoria Gray)在会上描述了她与镰状细胞病的斗争。2019 年,她接受了 CRISPR 治疗(来源:LLUIS MONTOLIU)
Vertex 的治疗需要进行骨髓移植。这本身就是一种折磨,并不是每个病人都能做好准备。Vertex 认为这种治疗将适用于“严重的”病例,据估计欧洲和美国有大约 3.2 万人符合条件。
即便如此,如果保险公司和政府不愿支付费用,患者也得不到治疗。这是一个真实存在的风险。例如,Bluebird Bio 公司开发的另一种地中海贫血基因疗法,由于欧盟一些国家的政府拒绝支付 180 万美元的高价,后来不得不撤出欧洲市场。
02
CRISPR 2.0
第一代 CRISPR 疗法在另一个方面也受到了限制。一些人会使用这种工具来破坏 DNA,本质上是切断基因——这一过程被哈佛大学生物学家乔治·丘奇(George Church)称为“基因组破坏行为”。
试图破坏基因的治疗方法包括一种试图消灭艾滋病毒的治疗方法。另一个则是格雷使用的那种——通过破坏特定的 DNA,她接受的疗法解锁了人们通常只在婴儿时期使用的第二种血红蛋白基因。由于血红蛋白是镰状细胞中的错误蛋白质,启动另一个版本的血红蛋白解决了这个问题。
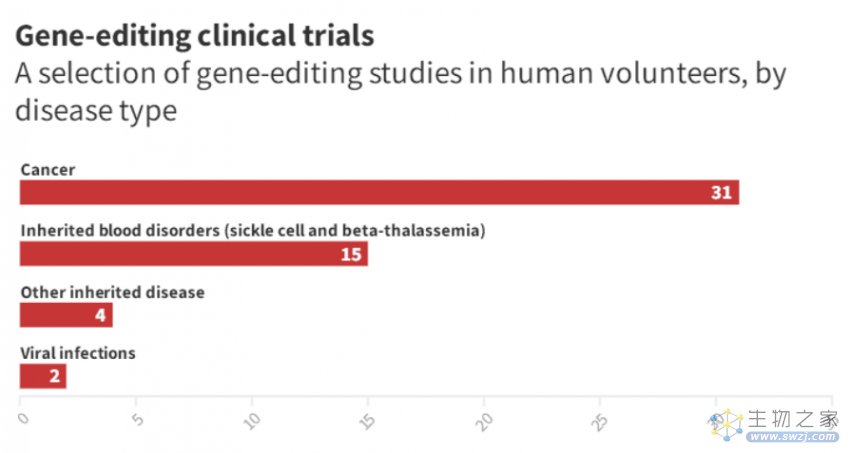
(来源:在 Clinicaltrials.gov 网站上公开的基因编辑试验)
根据刘的分析,目前三分之二的研究都旨在以这种方式“破坏”基因。刘的实验室正在研究下一代基因编辑方法。这些工具也使用了 CRISPR 蛋白,但它的设计并不是为了切割 DNA 螺旋,而是为了巧妙地交换单个基因字母或进行更大的编辑,这些方法又被称为“碱基编辑器”。
西班牙国家生物技术中心的基因科学家路易斯·蒙托利乌(Lluís Montoliu)表示,这些新版本的 CRISPR 具有“更低的风险和更好的性能”,尽管将它们“递送到体内正确的靶细胞”仍然很困难。
在实验室里,蒙托利乌正在使用碱基编辑器来治疗白化病小鼠,在某些情况下甚至是从出生开始的。他说,这是朝着新生儿可以接受的治疗迈出的一步,其目的不是为了改变外貌、肤色等特征。他希望把刘研究的分子放在人类眼睛里,以纠正白化病可能导致的严重视力问题。
然而,到目前为止,白化病项目并不是一个诱人的商业投资。这也表明了 CRISPR 在目前乃至于可预见的未来里的最大限制:几乎所有正在进行的 CRISPR 试验,都是针对癌症或镰状细胞病的,很多家公司都在尝试解决完全相同的问题。
根据乌尔诺夫的说法,这意味着其他数千种可以用 CRISPR 治疗的遗传性疾病都被忽视了。他说:“这是因为它们中的大多数都太罕见了,无法成为一个可行的商业机会。”
然而,在伦敦的会议上,乌尔诺夫提出了他的想法,包括如何针对超罕见的疾病进行测试,哪怕该疾病可能只有一个病例。
这不是一个商业机会,但因为 CRISPR 可以被编程进入基因组中的任何地方,所以这在科学上是可能的。乌尔诺夫说,现在基因编辑已经取得了第一次成功,我们“迫切需要”为所有人开辟一条“通往临床(治疗)的道路”。































