人类皮层分化是通过一系列时空有序的步骤,搭建了一套定位精准、功能协调的神经细胞层。这些步骤受一组基因网络引导和调控,其中的基因突变会导致神经发育失调以及神经精神紊乱【1】。外界环境巨变也可能是导致神经发育紊乱的病理性因素,但是,全面筛选和识别这些因素仍旧复杂和困难重重【2-5】。然而,遗传背景会在一定程度上会给予提示。
近日,来自奥地利Institute of Science and Technology Austria (ISTA) 的Gaia Novarino研究组在Cell上发表题为Large neutral amino acid levels tune perinatal neuronal excitability and survival的文章,通过对发育不同阶段的大脑皮层进行代谢组学检测分析,发现在围产期中,大中性氨基酸在调控神经元代谢、兴奋性以及生存率中具有至关重要的作用。

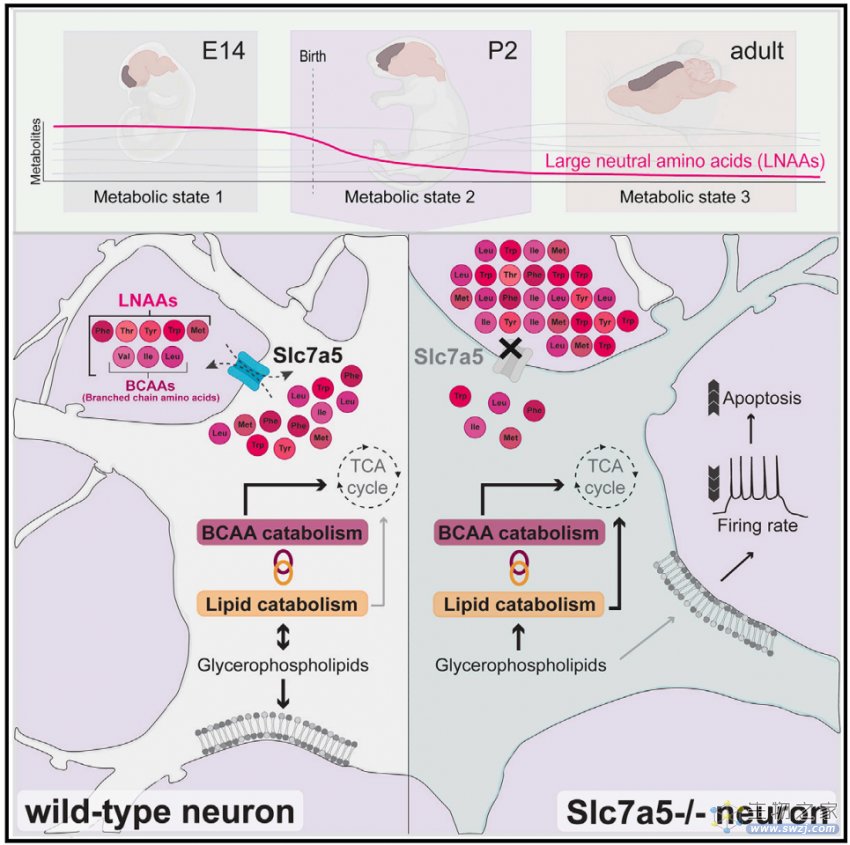
作者团队近期的工作发现,编码大中性氨基酸(large neutral amino acid)转运因子LAT1的基因SLC7A5,若发生突变则会导致一类罕见的泛自闭症障碍(autism spectrum disorders)【6】。大多数大中性氨基酸均为人体必需氨基酸,因此,这些氨基酸基本上都来源于人体摄食。当然,这些在大脑中是否会发生变化,以及如何变化,还有它们是如何影响神经发育的,仍旧不得而知。事实上,在大脑发育过程中,这些氨基酸的代谢途径以及所需组分也还不清楚。例如,新生婴儿的大脑代谢变化数据还没有详细报道。但这一过程颇为有趣,因为新生儿在努力适应新的喂养方式和外界环境之余,大脑还会进行一系列变化从而可以日渐成熟。了解特定营养物质如何影响大脑发育成熟,可能是预防或者是改善神经发育紊乱的关键之处。
作者对大脑发育各个阶段的大脑皮层样本进行代谢组学检测分析,从而可以从时间维度监测大脑变化。基于上述数据,作者发现,在发育过程中,前脑会经历重大代谢组变化。并通过改变神经细胞中Slc7a5表达水平,作者确定,皮层的大中性氨基酸和脂类代谢之间存在明确的相互关联。在神经细胞中敲除Slc7a5,可以影响新生儿代谢状态,从而导致脂类代谢变化。
作者还发现,围产期前脑对大中性氨基酸依赖性的增加具有一个时间窗口。因此,作者通过限制神经细胞所摄取的必需氨基酸水平,来研究围产期代谢水平变化。通过这种方式,作者发现了在上述瞬时时间窗口中,大中性氨基酸具有一类极为重要且颇为意外的功能。具体来说,作者发现,改变皮层神经元的大中性氨基酸水平可以改变其酯类代谢状态,以及其神经兴奋性和生存率,且这一过程是细胞自主调节的,并在新生阶段尤为明显。作者的工作建立了一套哺乳动物神经元保障大脑精准发育的有力模型,包括协同调节营养相关基因表达以及神经元活性等几方面方面;在一个短暂且极为重要的时间窗口改变上述过程可以导致大脑皮层发育永久性损伤。
综上所述,作者重点关注大脑皮层神经细胞的代谢谱变化,并将其视作神经元内在变化的监测指标之一以及大脑皮层回路发育完整性的决定因素之一。通过在不同阶段大脑皮层的代谢组学数据,作者绘制了完整且详尽的大脑代谢变化谱。其中,有一些变化代谢物参与大脑发育,作者也因此确定了决定大脑发育紊乱与否的关键窗口期。作者的工作证实,来自摄取食物营养因子,比如必须氨基酸在神经发育中的重要作用。在SLC7A5突变的人类和小鼠中均具有类似的代谢谱说明啮齿类和人类大脑至少在代谢层面是具有保守性的。
原文链接:https://doi.org/10.1016/j.cell.2023.02.037
参考文献
1. Parenti, I., Rabaneda, L.G., Schoen, H., and Novarino, G. (2020). Neuro- developmental disorders: from genetics to functional pathways. Trends Neurosci. 43, 608–621. https://doi.org/10.1016/j.tins.2020.05.004.
2. Galler, J.R., Bringas-Vega, M.L., Tang, Q., Rabinowitz, A.G., Musa, K.I., Chai, W.J., Omar, H., Abdul Rahman, M.R., Abd Hamid, A.I., Abdullah, J.M., et al. (2021). Neurodevelopmental effects of childhood malnutrition: A neuroimaging perspective. Neuroimage 231, 117828. https://doi.org/ 10.1016/j.neuroimage.2021.117828.
3. Rock, K.D., and Patisaul, H.B. (2018). Environmental mechanisms of neurodevelopmental toxicity. Curr. Environ. Health Rep. 5, 145–157. https://doi.org/10.1007/s40572-018-0185-0.
4. Ross, E.J., Graham, D.L., Money, K.M., and Stanwood, G.D. (2015). Developmental consequences of fetal exposure to drugs: what we know and what we still must learn. Neuropsychopharmacology 40, 61–87. https://doi.org/10.1038/npp.2014.147.
5. Stankovic, I.N., and Colak, D. (2022). Prenatal drugs and their effects on the developing brain: insights from three-dimensional human organoids. Front. Neurosci. 16, 848648.
6. Ta!rlungeanu, D.C., Deliu, E., Dotter, C.P., Kara, M., Janiesch, P.C., Scal- ise, M., Galluccio, M., Tesulov, M., Morelli, E., Sonmez, F.M., et al. (2016). Impaired amino acid transport at the blood brain barrier is a cause of autism spectrum disorder. Cell 167, 1481–1494.e18. https://doi.org/10. 1016/j.cell.2016.11.013.
7. Bond, A.M., Ming, G.-L., and Song, H. (2015). Adult mammalian neural stem cells and neurogenesis: five decades later. Cell Stem Cell 17, 385–395. https://doi.org/10.1016/j.stem.2015.09.003.
8. Candelario, K.M., Shuttleworth, C.W., and Cunningham, L.A. (2013). Neural stem/progenitor cells display a low requirement for oxidative metabolism independent of hypoxia inducible factor-1alpha expression. J. Neurochem. 125, 420–429. https://doi.org/10.1111/jnc.12204.































