关于恶性肿瘤前的细胞如何变成癌细胞,仍有许多东西有待发现。对一种人类白血病发展的分析表明,紫外线与触发一种罕见的癌症形式有关。
导致癌症从单一解剖部位的前恶性细胞发展的因素正变得越来越清晰。然而,驱使这些细胞系(克隆)导致疾病扩散的组织特异性环境压力的作用却不甚明了。格里芬(Griffin)等人在《自然》杂志上撰文,1研究了一种叫做blastic plasmacytoid dendritic cell neoplasm(BPDCN)的侵袭性白血病的发展,这种疾病通常通过在皮肤上出现恶性细胞而被诊断出来。作者的数据显示,一种免疫细胞通过皮肤的迁移导致了与暴露于紫外线(UV)有关的DNA损伤的积累。这种损伤先于获得与恶性肿瘤转化相关的突变,表明白血病前期细胞向皮肤的移动参与了BPDCN的早期阶段。

在过去十年中,科学家们发现,具有突变的细胞克隆的生长(扩张)在正常组织中是很常见的--这种现象被称为体细胞镶嵌。虽然大多数克隆不会发展成恶性疾病,但一些罕见的细胞可能会获得进一步的改变,促进它们在当地组织环境中的生存。
在血癌方面,存在与某些类型癌症(骨髓和淋巴肿瘤)有关的基因突变的血细胞系可以从干细胞或祖细胞群中产生。这被称为克隆性造血。从克隆造血到白血病的转变通常被认为是发生在骨髓中,当细胞获得进一步的合作突变,可能针对特定版本的基因。这可能会影响细胞所拥有的基因拷贝数,导致肿瘤抑制基因的丧失,或产生增加细胞生存的突变组合3,4。细胞外在因素,如癌症疗法或烟草烟雾,可能会增强携带特定突变5的克隆的生长,如TP53和ASXL1基因的突变。也有证据表明,这种克隆可以在发育中的胚胎早期建立,但直到生命后期才会导致癌症6。
疾病进展的临床模型表明,BPDCN可能同时起源于皮肤和骨髓。克隆造血在BPDCN患者中经常发生,而且已经证明克隆造血产生的细胞可以发展成BPDCN的克隆。了解导致BPDCN转化的进化路径对制定早期诊断和监测策略至关重要。
Griffin及其同事检查了16名BPDCN患者的数据集,并使用一系列基因组分析(包括全基因组测序、单细胞RNA测序和单细胞DNA测序)调查了该疾病的演变(图1)。其中七个人在皮肤和骨髓中有癌症生长(病变),而其他人则没有骨髓受累的迹象。出现的模型是最近的共同祖先(引起癌症的祖先系)是在骨髓的克隆造血过程中发展起来的克隆。最经常涉及的突变(79%的个体)针对涉及蛋白质TET2和IDH2的细胞信号通路。
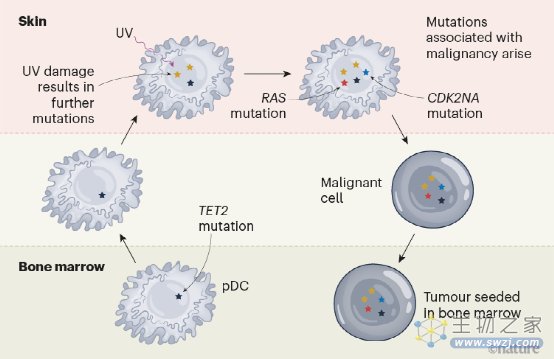
整合单细胞RNA-和DNA-测序结果显示,与克隆造血有关的突变是由称为多能祖细胞获得的,这些细胞很少有其他体细胞突变(突变不是遗传的,而是在生命后期获得)。单细胞基因表达分析显示,在有骨髓参与的癌症中,免疫细胞的分化偏向于产生一种叫做浆细胞树突状细胞(pDC)的细胞类型。这些细胞迁移到皮肤后,其突变数量(突变负担)有所增加。还有反复出现的针对CDKN2A、SETD2、TP53和RAS蛋白的突变事件的证据,这些突变在皮肤中观察到,而不是在骨髓中。
同样地,一些细胞系的进化仅限于骨髓,细胞积累了与皮肤癌不共享的特定突变。单细胞DNA测序和RNA测序的基因表达分析显示,pDCs携带的突变与疾病的起始(创始突变)和进展(次级进展突变)都有关。这些细胞还显示出BPDCN的独特特征,涉及TCL1A和BCL2以及其他基因的表达增加。
相比之下,没有骨髓参与的样本中的pDCs突变负担较低。此外,它们通常携带始发突变,但没有次级进展突变,也没有突出的BPDCN基因表达特征,尽管它们仍然显示TCL1A的表达增加。该基因先前被确认7在克隆造血中的造血干细胞和祖细胞的生存中具有关键作用,这一发现具有潜在的治疗意义,因此与格里芬及其同事的结果一致。
作者对紫外线相关的突变特征和克隆性的分析表明,紫外线诱导的损伤先于二次进展突变和恶性转化的获得。对紫外线相关突变特征的追踪表明,皮肤中的BPDCN细胞随后可以在其他解剖部位(包括以前未受影响的骨髓)播种,并可能导致皮肤中的癌症复发。
值得注意的是,紫外线诱导的DNA损伤并没有直接导致牵涉到BPDCN的突变。格里芬及其同事探讨了另一种假设,即暴露于紫外线辐射可能促进恶性肿瘤前期的pDCs生长。作者使用一种在实验室培养癌细胞的技术,将分化的细胞暴露在紫外线辐射下,观察到细胞死亡的剂量依赖性增加。然而,具有TET2突变的pDCs比具有正常TET2的细胞对紫外线诱导的死亡更有抵抗力,这表明TET2在暴露于紫外线的pDCs中具有肿瘤抑制作用。证据表明,TET2失活、皮肤定位和BPDCN中的细胞获得与紫外线相关的突变之间存在着密切的联系。这一观察可能至少部分地解释了为什么TET2途径的突变与BPDCN有关。
作者的研究结果表明,组织特异性的环境压力如何能推动恶性肿瘤前期克隆的进化,形成能影响局部(如皮肤)和远处(骨髓)部位的癌症。在这项研究中,癌症进化的达尔文模型本身就很复杂,而且是跨解剖学部位的分支。随着越来越多的证据表明体细胞嵌合的普遍性,有必要进一步调查遗传性突变、体细胞嵌合、塑造细胞生存的因素之间的相互作用,以及如Griffin等人所强调的,器官特异性突变在克隆细胞系产生的疾病进化中的作用。
鉴于能够收集单细胞数据的技术的发展,越来越有可能找到将肿瘤生长的各种测量方法联系起来的方法。仔细的研究设计,加上生物样本的收集和代表疾病演化的每个阶段的疾病模型的开发,可以加深我们对癌症发生和发展的理解,也可以指导开发针对恶性转化的关键因素的监测和拦截策略。
原文链接:https://www.nature.com/articles/s41586-023-06156-8































